题目内容
下表是KNO3、NaCl在不同温度下的溶解度
(1)在40℃时,100g水中能溶解氯化钠的最大质量为 .
(2)在20℃时,向100g水中,加入25g硝酸钾,充分溶解后,所得溶液中溶质的质量分数是 .
(3)某同学在配制食盐溶液时,发现很多因素都能影响食盐在水中溶解的速率,从你能想到的因素中,写出一项,并预测此因素对食盐溶解速率的影响结果,然后设计实验验证你的预测.
影响因素: .
该因素的影响结果: .
你设计的实验方案: .
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NaCl | 35.7 | 36 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 32 | 64 | 110 | 169 | 246 | |
(2)在20℃时,向100g水中,加入25g硝酸钾,充分溶解后,所得溶液中溶质的质量分数是
(3)某同学在配制食盐溶液时,发现很多因素都能影响食盐在水中溶解的速率,从你能想到的因素中,写出一项,并预测此因素对食盐溶解速率的影响结果,然后设计实验验证你的预测.
影响因素:
该因素的影响结果:
你设计的实验方案:
考点:固体溶解度的影响因素,影响溶解快慢的因素,有关溶质质量分数的简单计算
专题:溶液、浊液与溶解度
分析:(1)根据40℃时氯化钠的溶解度为36.6g进行解答;
(2)根据20℃时硝酸钾的溶解度为32g进行解答;
(3)根据改变食盐的微粒的运动速度和改变它们与水的接触面积能改变溶解的速率以及设计实验验证时只能有一个变量其它必须相同进行解答.
(2)根据20℃时硝酸钾的溶解度为32g进行解答;
(3)根据改变食盐的微粒的运动速度和改变它们与水的接触面积能改变溶解的速率以及设计实验验证时只能有一个变量其它必须相同进行解答.
解答:解:(1)40℃时氯化钠的溶解度为36.6g,所以在40℃时,100g水中能溶解氯化钠的最大质量为36.6g;故填:36.6g;
(2)20℃时硝酸钾的溶解度为32g,所以在20℃时,向100g水中,加入25g硝酸钾,硝酸钾会全部溶解,所得溶液中溶质的质量分数是=
×100%=20%;故填:20%;
(3)根据食盐在水中溶解快慢与构成食盐的微粒的运动速度有关,温度越高氯离子和钠离子运动速度越快,搅拌也能使它们的运动速度加快,破坏的是食盐附近的饱和现象,从而加速溶解.改变与水的接触面积也行,例如食盐的颗粒越大溶解越慢,颗粒越小溶解越快;
注意实验设计时只能允许一个变量,其它必须相同,取两烧杯体积一样但温度不同的水,分别加入质量相同、颗粒大小一样的少量食盐,分别记录食盐完全溶解所需的时间.
故答案为:温度;温度越高,食盐溶解越快;取两烧杯体积一样但温度不同的水,分别加入质量相同、颗粒大小一样的少量食盐,分别记录食盐完全溶解所需的时间.
(2)20℃时硝酸钾的溶解度为32g,所以在20℃时,向100g水中,加入25g硝酸钾,硝酸钾会全部溶解,所得溶液中溶质的质量分数是=
| 25g |
| 100g+25g |
(3)根据食盐在水中溶解快慢与构成食盐的微粒的运动速度有关,温度越高氯离子和钠离子运动速度越快,搅拌也能使它们的运动速度加快,破坏的是食盐附近的饱和现象,从而加速溶解.改变与水的接触面积也行,例如食盐的颗粒越大溶解越慢,颗粒越小溶解越快;
注意实验设计时只能允许一个变量,其它必须相同,取两烧杯体积一样但温度不同的水,分别加入质量相同、颗粒大小一样的少量食盐,分别记录食盐完全溶解所需的时间.
故答案为:温度;温度越高,食盐溶解越快;取两烧杯体积一样但温度不同的水,分别加入质量相同、颗粒大小一样的少量食盐,分别记录食盐完全溶解所需的时间.
点评:本题考查了溶液的相关知识,重点是抓住溶解度的实质进行分析,结合图表所提供的信息即可解决.

练习册系列答案
相关题目
为查处司机酒后驾车的行为,从2002年10月起,江苏省常州市的交警常用装有重铬酸钾(K2Cr2O7)的仪器检测司机的呼出气中是否含有酒精分子,因为酒中的酒精分子可以使橙红色的重铬酸钾变为绿色的硫酸铬(Cr2(SO4)3).重铬酸钾和硫酸铬中铬的化合价分别是( )
| A、+3、+5 |
| B、+5、+3 |
| C、+3、+6 |
| D、+6、+3 |
下列变化中,发生化学变化的是( )
| A、水的蒸发 | B、钢铁生锈 |
| C、粉笔折断 | D、蜡烛熔化 |
下列实验现象的描述不正确的是( )
| A、红磷在空气中燃烧产生大量白烟 |
| B、铁与氧气接触就能生成红色固体 |
| C、镁条和稀盐酸反应放出大量的热 |
| D、水在通电时两极都有气泡冒出 |
下列关于离子的说法,正确的是( )
| A、离子都是带电的原子 |
| B、离子是构成物质的最小微粒 |
| C、在化学变化中离子不能再分 |
| D、有些物质直接由离子构成,有些物质却是由原子直接构成的 |
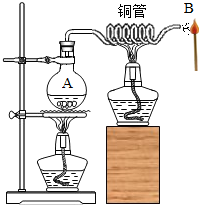 水蒸气能点燃火柴吗?做如图所示实验,加热烧瓶中的水使之沸腾,水蒸气通过加热的铜管喷出;把火柴靠近铜管口处,火柴被加热;迅速从水蒸气中移开,火柴燃着了.
水蒸气能点燃火柴吗?做如图所示实验,加热烧瓶中的水使之沸腾,水蒸气通过加热的铜管喷出;把火柴靠近铜管口处,火柴被加热;迅速从水蒸气中移开,火柴燃着了.