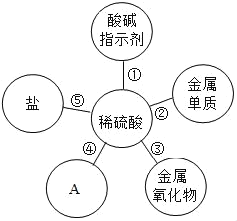
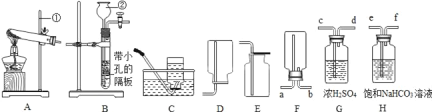
��Ŀ����
����Ŀ��ij��ѧ����С���ڵ���һ������ʱ�����мס����������䣬�ų��ķ�ˮ�����������м׳����ˮ���Գ����ԣ����������ʿ������Ȼ��⡢���ᡢ�����һ�ֻ��֣��ֶԸ÷�ˮ����̽����

��1���÷�ˮ������ɫʯ����Һ����_____ɫ��
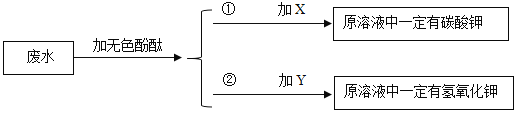
��2�������Լ�YΪ_____��
��3������ʵ������ó������Ե�����Ϊ_____��
�ҳ����ˮ�ʼ��ԣ���ˮ�����ʵ���ɿ������������ء�̼��ء�����ص�һ�ֻ�����ɣ���Ϊ̽������ɣ�����������̽����������ʵ����ա�
̽�����
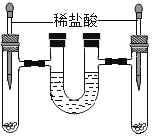
��4�����һ����Һ�м�������X��Һ�۲�����_____��
��5����ڶ�����Һ�м�������Y��Һ�ó����ۣ�ԭ��Һ��һ�������������ء���֤���ý��۵�������_____��
��6�������飬��ˮ�л���������ͭ���Ȼ�������Ӧ��_____���䣨����ң����ֽ��ס���������ķ�ˮ���ʵ��ı�����Ϻ�ɱ��Ϊ������Ϻ����Һ��һ�����ڵ�������_____��
���𰸡��� ������ ���� �����ݲ�������Һ�ɺ�ɫ��Ϊ��ɫ �г�������������Һ��ɫ��Ϊ��ɫ �� ����غ��Ȼ���
��������
��1�����ڷ�ˮ���Գ����ԣ��ʸ÷�ˮ������ɫʯ����Һ���ʺ�ɫ�������
��2�������ˮ�еμӹ��������ᱵ��Һ�������ᣬ��ʹ������ȫ��Ӧ����ֹ�Ժ��������ӵļ������Ӱ�죬�������ᱵ������������֤��������ټ��������������������Ȼ��⣬����������֤�����Ȼ��⣻���������
��3�����ݵμӹ��������ᱵ��Һ�������ᣬ�������ᱵ������������֤��������ټ��������������������Ȼ��⣬����������֤�����Ȼ��⣬�ó������Ե�����Ϊ���ᡣ�������
��4�����һ����Һ�м���������ϡ������Һ�۲쵽�����ǣ������ݲ�������Һ�ɺ�ɫ��Ϊ��ɫ����������ݲ�������Һ�ɺ�ɫ��Ϊ��ɫ
��5����ڶ�����Һ�м��������Ȼ�þ��Һ���Ȼ�þ���������ط�Ӧ����������þ�����������ɵ�һ�ݿ�֪һ����̼��أ������г�������������Һ��ɫ��Ϊ��ɫ�����Եó����ۣ�ԭ��Һ��һ�������������ء�����г�������������Һ��ɫ��Ϊ��ɫ
��6�������飬��ˮ�л���������ͭ���Ȼ�����Ӧ���ڼ�ˮ�У���Ϊ�ҷ�ˮ�к����������غ�̼��ػ�������ͭ���Ȼ������ɳ�������Ӧ�ڼ�ˮ�У��ֽ���������ͭ���Ȼ������Һ����������غ�̼��أ�������ķ�ˮ���ʵ��ı�����Ϻ�ɱ��Ϊ������Ϻ����Һ�е��������Ӧ�����ܹ���Ӧ���ﵽ��ȫ����һ���е��Ƿ�Ӧ��IJ��һ�����ڵ�����������غ��Ȼ��ء�����ף�����غ��Ȼ���

����Ŀ�������NaCl��KNO3�ڲ�ͬ�¶�ʱ���ܽ�ȣ�
�¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ��/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
��1����Ҫ�Ƚ�KNO3�� NaCl��ˮ�е��ܽ���������Ҫ���Ƶı�����ˮ��������______��
��2��60��ʱ����100 gˮ�м���100 g KNO3���壬��ֽ����õ�______����������������������������Һ����ʱ����Һ�����ʵ���������Ϊ______�������¶���ȴ��20�����ձ����������������Ϊ______g����ʱ��Һ��������������Ϊ______����ȷ��0.01%����
��3����10��ʱ��NaCl������Һ��������������______������������������������С������KNO3������Һ������������������50��ʱ��12gˮ��������ܽ�______ gNaCl��