题目内容
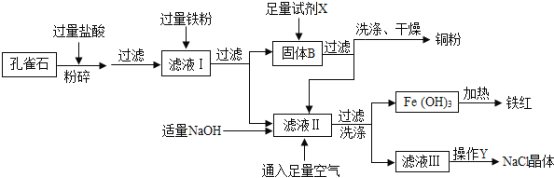
【题目】孔雀石是冶炼金属铜的主要原料,其主要成分是Cu2(OH)2CO3〔可看成是Cu(OH)2CuCO3〕,还含少量氧化铁和二氧化硅(不溶于水,也不与酸反应)。以下为“湿法炼铜”并制备其它副产品氯化钠和铁红(氧化铁)的工业流程。
资料:
(1)Cu2(OH)2CO3与盐酸反应生成氯化铜、水和二氧化碳气体;
(2)铁能与氯化铁溶液反应,反应方程式为2FeCl3+Fe═3FeCl2
(3)氢氧化亚铁易被氧气氧化,反应方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3
回答下列问题:
(1)写出盐酸与Cu2(OH)2CO3反应的化学方程式:_____________ ;
(2)氧化铁与稀盐酸反应的现象是_______________
(3)滤液Ⅱ的溶质为:_______________;
(4)实验操作Y中,使用玻璃棒的作用是____________;
(5)在洗涤、干燥获取铜粉时,洗涤的目的是_____________。
【答案】Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2![]() 红色固体逐渐消失,溶液由无色变为黄色 FeCl2、HCl(或氯化亚铁、氯化氢) 搅拌,防止局部温度过高,造成液滴飞溅 洗掉铜粉上附着的氯化亚铁溶液
红色固体逐渐消失,溶液由无色变为黄色 FeCl2、HCl(或氯化亚铁、氯化氢) 搅拌,防止局部温度过高,造成液滴飞溅 洗掉铜粉上附着的氯化亚铁溶液
【解析】
(1)由资料可知,Cu2(OH)2CO3与盐酸反应生成氯化铜、水和二氧化碳气体,故填写:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2![]() ;
;
(2)氧化铁与稀盐酸反应生成氯化铁和水,氯化铁为红褐色固体,稀盐酸为无色溶液,氯化铁为黄色溶液,因此,观察到的实验现象是:红褐色固体逐渐消失,溶液由无色变为黄色,故填写:红褐色固体逐渐消失,溶液由无色变为黄色;
(3)滤液Ⅱ是通过孔雀石与盐酸反应,生成物氯化铜与铁粉反应得到的,因此,滤液Ⅱ中一定有氯化铜和铁的生成物氯化亚铁,由于盐酸过量,所以,也一定有盐酸的溶质,故滤液Ⅱ的溶质为:FeCl2、HCl(或氯化亚铁、氯化氢);
(4)实验操作Y是把滤液III转化为NaCl晶体,由图实验流程分析可得, 滤液III的溶质是氯化钠,因此,操作Y为蒸发,在蒸发的过程中,要用玻璃棒不断搅拌溶液,防止受热不均,造成液滴飞溅,故填写:搅拌,防止局部温度过高,造成液滴飞溅;
(5)铜粉是从氯化亚铁溶液中过滤出来的,其表面沾有氯化亚铁,需要用水进行清洗,故填写:洗掉铜粉上附着的氯化亚铁溶液。

 中考解读考点精练系列答案
中考解读考点精练系列答案