题目内容
【题目】某化学兴趣小组围绕“酸和碱的反应”,做了如下图所示的两个实验:
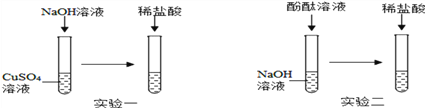
(1) 实验一:向CuSO4溶液中滴入NaOH溶液,观察到的现象为____________,该反应的化学方程式为____________,继续滴加稀盐酸,通过稀盐酸与____________反应的现象,证明了酸和碱能发生反应。
(2) 向NaOH溶液中滴入几滴酚酞溶液,振荡,继续加入稀盐酸,观察到溶液由____________色变为无色,由此现象也证明了酸和碱能发生反应。
实验结束后,小组同学对实验二中试管内的无色溶液成分展开了讨论。
【提出问题】试管中无色溶液的溶质除酚酞外还有什么?
【猜想假设】猜想一:NaCl和HCl 猜想二:____________
【实验设计】若要证明猜想一成立,下列试剂中不能达到实验目的是____________
A.紫色石蕊溶液 B.Cu C.AgNO3 D.Na2CO3
【讨论交流】小莹同学认为滴入NaOH溶液,也能证明猜想一成立,你认为小莹同学的方案是否可行并说明理由____________。
【反思评价】判断中和反应是否发生,____________(填“一定”或“不一定”)借助指示剂。
【答案】 产生蓝色沉淀 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 Cu(OH)2(或名称) 红 NaCl BC 可行,若滴入NaOH溶液后没有立即变红,则说明猜想一成立 不一定
【解析】(1)根据氢氧化钠与硫酸铜反应的现象、酸的性质来分析;(2)根据无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,进行分析解答;【猜想假设】根据稀盐酸与氢氧化钠溶液反应生成氯化钠和水,滴有酚酞的溶液显无色,进行分析解答;【实验设计】若要证明猜想一成立,即证明是否有盐酸存在,可结合酸的化学性质,进行分析解答;【讨论交流】根据氢氧化钠与稀盐酸反应解答;【反思评价】根据难溶性碱与酸反应判断。(1)CuSO4溶液与NaOH溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,观察到的现象为有蓝色沉淀生成;反应的化学方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;继续滴加稀盐酸,氢氧化铜沉淀能与稀盐酸反应生成氯化铜和水,反应的现象,通过稀盐酸与氢氧化铜反应的现象(蓝色沉淀消失),证明了酸和碱能发生反应;(2)NaOH溶液显碱性,滴入几滴酚酞溶液,向NaOH溶液中滴入几滴酚酞溶液,振荡,变红色,继续加入稀盐酸,观察到溶液由红色,说明碱性物质消失,由此现象也证明了酸和碱能发生反应;【猜想假设】稀盐酸与氢氧化钠溶液反应生成氯化钠和水,滴有酚酞的溶液显无色,说明溶液显酸性或中性,猜想一:NaCl和HCl;猜想二:该溶液中的溶质是NaCl;【实验设计】若要证明猜想一成立,即证明是否有盐酸存在,盐酸能使紫色石蕊溶液变红色,能与碳酸钠反应生成二氧化碳气体;不能与铜反应,能与硝酸银溶液反应生成氯化银白色沉淀,但氯化钠也能与硝酸银溶液反应,不能证明是否有盐酸存在。故选BC;【讨论交流】小莹同学认为滴入NaOH溶液,也能证明猜想一成立,方案可行。理由是:若滴入NaOH溶液后没有立即变红,则说明猜想一成立;【反思评价】判断中和反应是否发生,不一定借助指示剂。如通过稀盐酸与氢氧化铜反应的现象(蓝色沉淀消失),证明了酸和碱能发生反应。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A | B |
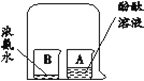
|
|
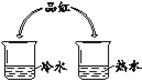
从微粒角度解释: (1)品红在水中扩散的原因是______。 (2)品红在热水中扩散速度快,其原因是______。 | (1)实验现象是______。 (2)实验结论是______。 |