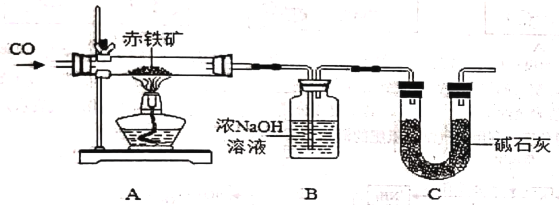
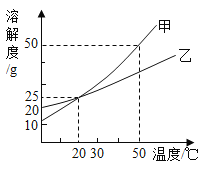
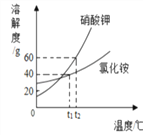
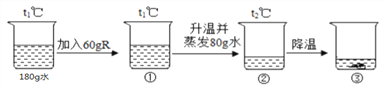
题目内容
【题目】将一定量铁粉加入到硝酸银和硝酸铜的混合溶液中,反应后溶液呈蓝色。
(1)反应后溶液的质量有何变化__________?
(2)写出一定发生的反应的化学方程式__________。
(3)请你分析反应后得到的蓝色溶液中溶质的成分__________。
【答案】质量减少 ![]() 硝酸铜、硝酸亚铁
硝酸铜、硝酸亚铁
【解析】
三种金属活动性由强到弱的顺序:铁>铜>银,当把铁粉加入到硝酸铜和硝酸银的混合溶液中时,银首先被置换出来,在银完全置换后,铜才能被置换出来。
(1)三种金属活动性由强到弱的顺序:铁>铜>银,当把铁粉加入到硝酸铜和硝酸银的混合溶液中时,银首先被置换出来,在银完全置换后,铜才能被置换出来,反应后溶液呈蓝色,铁可能没有置换出铜,有可能置换出部分铜,56份铁置换出216份的银,56份的铁置换出65份的铜,故反应后溶液的质量减少。
(2)三种金属活动性由强到弱的顺序:铁>铜>银,当把铁粉加入到硝酸铜和硝酸银的混合溶液中时,银首先被置换出来,一定发生的反应是铁和硝酸银反应生成硝酸亚铁和银,反应的化学方程式为![]() 。
。
(3)把铁粉加入到硝酸铜和硝酸银的混合溶液中时,银首先被置换出来,在银完全置换后,铜才能被置换出来,反应后溶液呈蓝色,铁可能没有置换出铜,有可能置换出部分铜,故反应后得到的蓝色溶液中溶质的成分为硝酸铜、硝酸亚铁。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目