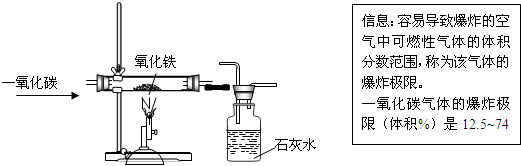
题目内容
5、化学上常用化学式来表示物质,以下是一些常见物质的化学式:
①Fe2O3 ②NH4Cl ③NaCl ④CH4 ⑤CaCO3 ⑥H2O2
请按要求填空(每空只选填一个编号):
(1)用于配制生理盐水的物质
(3)实验室用来制氧气的物质
(5)农业上可用作化肥的物质
①Fe2O3 ②NH4Cl ③NaCl ④CH4 ⑤CaCO3 ⑥H2O2
请按要求填空(每空只选填一个编号):
(1)用于配制生理盐水的物质
③
; (2)天然气的主要成分④
;(3)实验室用来制氧气的物质
⑥
; (4)赤铁矿的主要成分①
;(5)农业上可用作化肥的物质
②
; (6)大理石的主要成分⑤
.分析:根据物质的组成性质分析:氧化铁在赤铁矿中含量较大,氯化铵中含有氮元素,常用作化肥,0.9%的氯化钠溶液是生理盐水,甲烷是天然气的主要成分,石灰石和大理石的主要成分是碳酸钙,过氧化氢分解能生成氧气.
解答:解:(1)用于配制生理盐水的物质是氯化钠,故填:③;
(2)天然气的主要成分是甲烷,故填:④;
(3)实验室用来制氧气的物质是过氧化氢,故填:⑥;
(4)赤铁矿的主要成分是氧化铁,故填 ①;
(5)农业上可用作化肥的物质氯化铵,故填:②;
(6)大理石的主要成分是碳酸钙,故填:⑤.
(2)天然气的主要成分是甲烷,故填:④;
(3)实验室用来制氧气的物质是过氧化氢,故填:⑥;
(4)赤铁矿的主要成分是氧化铁,故填 ①;
(5)农业上可用作化肥的物质氯化铵,故填:②;
(6)大理石的主要成分是碳酸钙,故填:⑤.
点评:解答本题的关键是熟悉各种物质的成分,能根据物质的性质推测物质的用途.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
图A与B是实验室常用来制取气体的装置,根据所学知识回答以下问题:
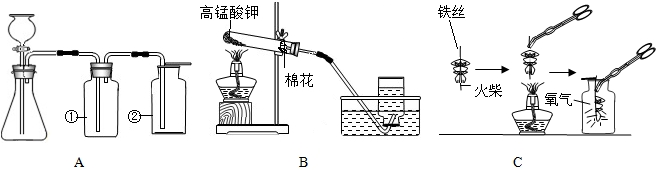
(1)装置A中②的仪器名称是 ,若想用装置A来制取的氧气,使用的药品是 (填化学式);若想制取CO2,应选择装置 (填“A”或“B”).
(2)装置B表示正在用高锰酸钾制取氧气,其中还缺少的仪器是 ,该反应的化学方程式为 ,实验完毕,为防止水倒吸,应 .
(3)装置A气密性的检验:先关闭分液漏斗活塞, ,用热毛巾捂住瓶①,若 ,则该装置漏气.
(4)图C中螺旋状铁丝的末端系一根火柴的作用是 .
(5)小明对铁丝在氧气中燃烧为什么会火星四射进行探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析回答:
小明按图C实验时,上表中“未填”的实验现象是 _
铁丝在氧气中燃烧为什么会火星四射?原因 .

(1)装置A中②的仪器名称是
(2)装置B表示正在用高锰酸钾制取氧气,其中还缺少的仪器是
(3)装置A气密性的检验:先关闭分液漏斗活塞,
(4)图C中螺旋状铁丝的末端系一根火柴的作用是
(5)小明对铁丝在氧气中燃烧为什么会火星四射进行探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析回答:
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
(未填) |
铁丝在氧气中燃烧为什么会火星四射?原因

 碳酸氢钠(NaHCO3 )俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3 )俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.