题目内容
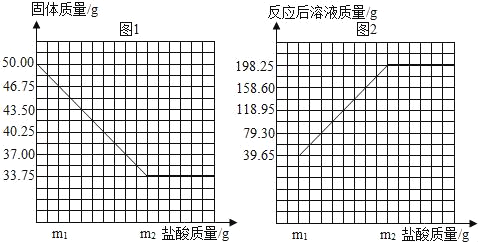
【题目】普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如图。问:
(1)黄铜中Cu的质量分数。
(2)样品完全反应产生的H2的质量。
(3)稀盐酸的溶质质量分数。
【答案】(1)67.5%;(2)0.5g;(3)10%
【解析】
(1)根据黄铜中铜不与盐酸反应,由图1可知黄铜完全反应后所剩余的质量即铜的质量;
(2)根据反应的化学方程式,由完全反应时消耗锌的质量,计算产生氢气的质量;
(3)根据质量守恒定律,由图2完全反应后所得溶液质量及所消耗锌的质量、放出氢气的质量,计算所加入稀盐酸的质量;根据化学方程式,由消耗锌的质量计算出稀盐酸中溶质HCl的质量;使用溶质质量分数算式,计算稀盐酸的溶质质量分数。
解:(1)根据铜不能与盐酸反应,由图1可得黄铜中铜的质量为33.75g;黄铜中Cu的质量分数:![]() =67.5%;
=67.5%;
(2)黄铜中锌的质量=50.00g﹣33.75g=16.25g;设完全反应产生的H2的质量为x,设完全反应时消耗盐酸的质量为y,
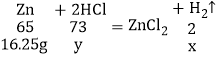
![]() x=0.5g,
x=0.5g,
![]() y=18.25g,
y=18.25g,
(3)稀盐酸的溶质质量分数=![]() ×100%=10%;
×100%=10%;
答:(1)黄铜中Cu的质量分数67.5%;
(2)样品完全反应产生的H2的质量为0.5g;
(3)稀盐酸的溶质质量分数为10%。

练习册系列答案
相关题目