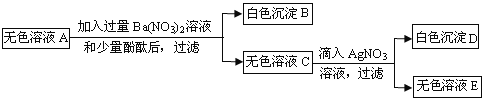
��Ŀ����
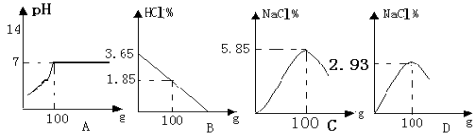
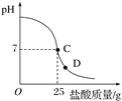
����Ŀ��Ϊ�ⶨ������������Ϊ32%�������ʵ������������С��ʵ��ʱ�����ձ��м���20 g 40%������������Һ������μ�������ᣬ�ⶨ������������������ձ�����ҺpH�Ĺ�ϵ��ͼ��
(1)��������������Һ�����ʵ�����Ϊ_____g��
(2)�����濴����ͼ��Ϣ��ش��������⡣
�ٵ��μ����ᵽC��ʱ�������ĵ����������ʵ������Ƕ��٣�_____��
�ڸ������ʵ�����������Ƕ��٣�(������0.1%)_____��
�۵���������Һ���������������ı��ԭ����_____��
�ܵ��μ����ᵽͼ����D��ʱ���ձ�����Һ��������_____(�ѧʽ)��
���𰸡���1��8g����1�֣�
��2����7.3�ˣ�1�֣� ��29. 2% (2��)
�������лӷ��� ����1�֣� ��HCl��NaCl ����2�֣���1�֣�
��������
��1��NaOH������=20g��40%=8g
��2����C��ʱ��PH=7˵���������ƺ�����ǡ����ȫ����20������������Һ��25������ǡ����ȫ��Ӧ���������е����ʵ�������X��
NaOH + HCl =" NaCl" + H2O
40 36.5
8�� X
40��36.5 ��8g��X ��ã�X=7.3g
����������ʵ���������7.3g/25g��100%�T29.2%��
��������лӷ��ԣ�������Һ���е��������٣��ܼ����䣬���ϡ�����Ũ����ϡ��
������D��ʱ����Һ������˵�������Ѿ���������ʱ��Һ�����������ɵ�NaCl�����й�����HCl��

����Ŀ����ʵ��عˣ����ձ��м���Լ 5mL ϡ����������Һ�����뼸�η�̪��Һ���õ� ����������ϡ���ᣬ�����Ͻ��衣
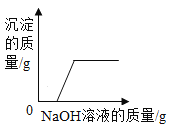
��1����ʵ��֤��������� NaOH ��Һ�ܷ�����ѧ��Ӧ�����ݵ�������_____��
��2����Ӧ�Ļ�ѧ����ʽΪ_____��
��̽��� 1��ͨ��֤����ˮ������֤����ͼ�֮�䷴Ӧ�ķ�����
���������ϣ�a����ɫ�轺��ˮ������ɫ��Ϊ��ɫ��b����ˮ������һ���ᣬ������Ϊ��ɫҺ�塣
�����ʵ�飩ȡ��ɫ�轺����ˮ������������ƹ��������ͼ 1 ��ʾ��ʵ�顣
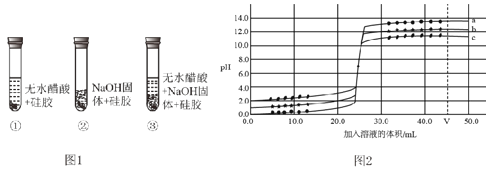
��1�������Լ���ҪѸ������������ԭ���� _____��
��2������ʵ������֤����ͼӦ��ˮ���ɵ�������_____��
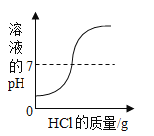
��̽��� 2��ͨ�� pH �仯��֤����ͼ�֮�䷴Ӧ�ķ�����ͼ 2 Ϊ���ֲ�ͬŨ�ȵ������� ����Һ���ӦŨ�����ᷴӦ�����ߡ�
��1����ʵ����_____������ĸ����
A �������������������Һ�� B ������������Һ����������
��2������������ʾʵ���У���������Ũ��������_____������a������b������c������
��3��������Һ���Ϊ VmL ʱ��������Һ��������_____��д��ѧʽ����
����չ���죩ijͬѧ�������ϵ�֪������ pH ����Һ�� H+Ũ�������¹�ϵ��
H+Ũ�ȣ���λ�ԣ� | 0.1 | 0.01 | 0.001 | 0.0001 | �� |
pH | 1 | 2 | 3 | 4 | �� |
��1��pH=6 ʱ��Һ�� H+��Ũ��Ϊ_____��
��2������˵����ȷ����_____������ĸ����
A H+Ũ��Խ��pH ԽС
B pH=1 �������� pH=3 �������Ϻ�������Һ pH Ϊ 2
C �ⶨ����� pH ʱ���Ƚ� pH ��ֽ��ˮ��ʪ���ٽ�����Һ���� pH ��ֽ��
D ��������ͬ��ϡ�����зֱ�ӵ������ˮ������������Һ����Һ pH ����̶���ͬ
��3���Ʋ⽫ pH=5 �������ˮϡ���� 1000 ��ʱ����Һ�� pH_____������ĸ����
A ���� 6 B ���� 7 C ���� 8 D ���϶�����