题目内容
【题目】在一定温度下,向20g Na2CO3和NaCl的固体混合物中加入101g水,溶解后,再向其中加入100g CaCl2溶液,恰好完全反应,过滤,所得滤液的质量为211g,将滤渣洗涤、干燥,称得其质量为m,试计算:
(1)m为多少g。
(2)当恰好完全反应时,所得溶液中溶质的质量分数为多少?
【答案】(1)10
(2)解:设原固体混合物中碳酸钠的质量为x,反应后生成氯化钠的质量为y。
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100 117
x 10g y
![]() =
=![]() x=10.6g
x=10.6g
![]() =
=![]() y=11.7g
y=11.7g
所得溶液中溶质的质量分数:![]() ×100%=10%
×100%=10%
答:所得溶液中溶质的质量分数为10%。
【解析】(1)由质量守恒定律可知反应前后物质的总质量不变,所以滤渣的质量=20g +101g+100g -211g=10g,由于碳酸钠和氯化反应生成碳酸钙沉淀和和易溶于水的氯化钠,所以滤渣为碳酸钙的质量,然后利用化学方程式中碳酸钠和氯化钠和碳酸钙的质量关系可计算碳酸钠和氯化钠的质量。
(2)解:设原固体混合物中碳酸钠的质量为x,反应后生成氯化钠的质量为y。
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100 117
x 10g y
![]() x=10.6g
x=10.6g
![]() y=11.7g
y=11.7g
所得溶液中溶质的质量分数:![]() ×100%=10%
×100%=10%
答:所得溶液中溶质的质量分数为10%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
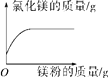
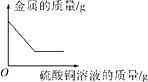
【题目】下列图像能正确反应对应变化的是(____)
A |
| 向一定质量的盐酸中加入镁粉至过量 |
B |
| 向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液 |
C |
| 加热一定量的高锰酸钾固体 |
D |
| 向氢氧化钠溶液中加入X,X可能是________ |
A. A B. B C. C D. D