题目内容
【题目】氯化铵与硝酸钾是两种常见的化肥。氯化铵与硝酸钾在不同温度下的溶解度如下:
温度(℃) | 10 | 30 | 50 | 60 | |
溶解度 (g/100gH2O) | 氯化铵 | 33.3 | 41.4 | 50.4 | 55.0 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110.0 | |
(Ⅰ)从表可知,50℃时,50克水中最多可以溶解氯化铵______克。
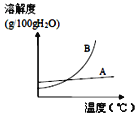
(Ⅱ)烧杯A是60℃时,含有100g水的氯化铵不饱和溶液,经过如下图的变化过程(在整个过程中,不考虑水分的蒸发),则到C烧杯溶液的质量为________g。
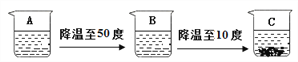
(Ⅲ)硝酸钾的溶解度曲线是_______(填“A”或“B”);50℃时,50g 水中加入45g 硝酸钾,充分溶解后,所得溶液的溶质质量分数为__________(精确到0.01);若要在含有少量氯化铵的硝酸钾溶液中,提取硝酸钾,可采用的方法是_________。
(Ⅳ)如图所示实验,除了验证氯化铵溶于水外,还有探究________的目的,实验探究结论是_______________。
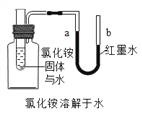
【答案】 25.2 133.3 B 46.09% 降温结晶 NH4Cl溶于水是放热还是吸热 NH4Cl固体溶于水吸热
【解析】(Ⅰ)溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。从表可知,50℃时,氯化铵的溶解度为50.4g,50克水中最多可以溶解氯化铵25.2克。(2).由图可知,C烧杯溶液中析出晶体,为饱和溶液; 10℃时,氯化铵的溶解度为33.3g,所以100g水形成的饱和溶液的质量为 133.3g (3). 由表格中熟记可知,硝酸钾的溶解度受温度影响较大,所以B是硝酸钾的溶解度曲线; (4). 50℃时,硝酸钾的溶解度是85.5g,50g 水中加入45g 硝酸钾,充分溶解后,有晶体剩余,得硝酸钾的饱和溶液,饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100%,故所得溶液的溶质质量分数为85.5g ÷(100g+85.5g)×100%=46.09% (5). 将含有少量氯化铵的硝酸钾溶液饱和溶液降温时,硝酸钾结晶析出,氯化铵因溶解度受温度影响小,且含量少,几乎完全溶解,析出的全是硝酸钾; (6). 由图可知,氯化铵溶解时,U型管内左边液面上升,说明左边气压降低,证明NH4Cl溶于水是吸热 ;