题目内容
【题目】许多科学发现从重视微小差异开始。科学家瑞利和拉姆塞正是重视氮气密度的微小差异,才最终发现了稀有气体氩气。

材料一:1892年瑞利发现,在相同条件下,由空气中除去氧气、二氧化碳、水蒸气和灰尘后获得的氮气,其密度为1.2572克/升;由含氮化合物反应并除去水蒸气后获得的氮气(NH4NO2==N2↑+2H2O),其密度为1.2505克/升,两者密度差值虽小;却完全超出了实验误差范围。
材料二:1894年4月瑞利和拉姆塞开始用如图装置进行“清除空气中氮气”的实验研究:在倒立圆底烧瓶内引入两根金属导线,通电使瓶中空气里的氧气和氮气生成氮的氧化物,用碱液来吸收生成的氮的氧化物和原有的二氧化碳气体。并从气体进口不断向瓶内补克氧气,使反应持续进行。
材料三:瑞利和拉姆塞又设计了另一实验装置,将上述实验所得的气体干燥后,通过红热的铜粉来除去其中的氧气,得到少量的剩余气体,对剩余气体做光谱分析得知,这是一种未知的气体,并测得其密度约是氮气的1.5倍。1894年8月13日他们共同宣布:发现了一种未知气体,并命名为氩气。
材料四:1898年拉姆塞等人利用不同的物质沸点不同,又发现了氪气、氖气、氙气。
根据上述材料,回答下列问题:
(1)与纯净氮气密度值更接近的是由 获得的氮气密度值(填“空气中”或“含氮化合物反应”);
(2)实验中不断向瓶内补充氧气的目的是 ;
(3)在当时实验条件下,很难利用化学反应除去氩气,获知“未知气体”中还有其它气体存在,其理由是 。
【答案】(1)含氮化合物反应 (2)使瓶内氮气反应完全 (3)氨气化学性质很不活泼,“未知气体”中的其它气体的化学性质与氨气相近
【解析】(1)有两种方法获得的氮气的密度值相比较可知,由含氮化合物反应获得的氮气密度值更接近纯净氮气密度值;
(2)要得到更准确的氮气密度值,需将氮气反应完全。故实验中不断向瓶内补充氧气的目的是:使瓶内氮气反应完全;
(3)在当时实验条件下,很难利用化学反应除去氩气,获知“未知气体”中还有其它气体存在,其理由是氨气化学性质很不活泼,“未知气体”中的其它气体的化学性质与氨气相近。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
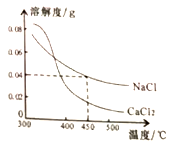
小学课时特训系列答案【题目】氯化铵与硝酸钾是两种常见的化肥。氯化铵与硝酸钾在不同温度下的溶解度如下:
温度(℃) | 10 | 30 | 50 | 60 | |
溶解度 (g/100gH2O) | 氯化铵 | 33.3 | 41.4 | 50.4 | 55.0 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110.0 | |
(Ⅰ)从表可知,50℃时,50克水中最多可以溶解氯化铵______克。
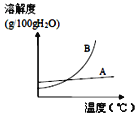
(Ⅱ)烧杯A是60℃时,含有100g水的氯化铵不饱和溶液,经过如下图的变化过程(在整个过程中,不考虑水分的蒸发),则到C烧杯溶液的质量为________g。
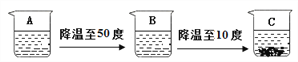
(Ⅲ)硝酸钾的溶解度曲线是_______(填“A”或“B”);50℃时,50g 水中加入45g 硝酸钾,充分溶解后,所得溶液的溶质质量分数为__________(精确到0.01);若要在含有少量氯化铵的硝酸钾溶液中,提取硝酸钾,可采用的方法是_________。
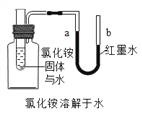
(Ⅳ)如图所示实验,除了验证氯化铵溶于水外,还有探究________的目的,实验探究结论是_______________。
【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如下图。同学们欲研究一包久置的“504双吸剂”固体样品,设计了如下实验进行探究。

【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
【提出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
【实验探究】甲同学的方案如下表,请你帮助他完成实验。
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不容物;溶液变红 | 固体中一定含有_____和Ca(OH)2 |
(2)另取少量固体于试管中,滴加足量的_____ | 固体逐渐消失,有无色气体产生,得到浅绿色溶液 | 固体中一定含有Fe,一定不含Fe2O3 |
(3)将步骤(2)中产生的气体通入澄清石灰水中 | _________ | 固体中一定含有CaCO3 |
【实验分析】
乙同学认为甲同学的实验中不能得出“一定含Ca(OH)2的结论”,理由是_________。
丙同学认为甲同学的实验并不能得出“一定不含Fe2O3的结论”,理由是_________。
【继续探究】为验证固体中是否含有Fe2O3,乙组同学用____________先分离出铁粉,向残留固体中加入足量____________,若溶液呈棕黄色,证明固体中含有Fe2O3。该溶液呈棕黄色的原因是:_________________________________(用化学方程式表示)。
【题目】某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸,用右图装置完成表中实验,回答下列问题。
![]()
实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 |
出现铁锈 所需时间 | 1天 未见锈蚀 | 5分钟 | 1天 未见锈蚀 | 1分钟 |
(1)铁锈的主要成分是________(填化学式)。
(2)实验②和④可探究________因素对铁制品锈蚀快慢的影响;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是______________(填实验序号)。
(3)根据表中实验现象得出的结论是_________________(写出1点即可)。
(4)影响铁制品的锈蚀快慢除上述因素外,还有______________________(写出1点即可),请设计实验方案_________________________________________________。