题目内容
【题目】(5分)海洋是人类宝贵的自然资源,从海水中可以得到粗盐。
(1)称取5.0g粗盐,逐渐加入10mL水中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止。还需要进行的实验步骤依次为:①称量剩余粗盐、② 、③ 、④称量精盐、⑤计算产率。
(2)下图是某工厂利用粗盐水生产纯碱的工艺流程图。
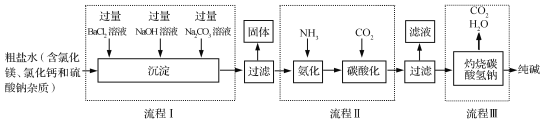
①下列说法正确的是 (填字母)。
A.流程Ⅰ中加入溶液的顺序不能改变
B.流程Ⅰ将粗盐水中的SO42-、 Mg2+、Ca2+转化为沉淀
C.流程Ⅰ后过滤得到三种沉淀
D.流程Ⅲ中发生的是分解反应
②流程II中发生的主要反应为NH3+CO2+H2O NH4HCO3 ,
NH4HCO3+NaCl NaHCO3↓+NH4Cl 。
20℃时,向100g水中加入11.7g NaCl和15.8g NH4HCO3,充分反应后,理论上从溶液中析出晶体的质量为 g(20℃时,NaHCO3的溶解度为9.7g, NH4Cl的溶解度为37.2g)。
【答案】(1)过滤 蒸发 (2)①BD ②7.1
【解析】
试题分析:(1)粗盐提纯实验步骤依次为:①称量剩余粗盐、②过滤、③蒸发、④称量精盐、⑤计算产率
(2)①流程图中加入的BaCl2溶液是为了除去杂质硫酸镁,反应为:MgSO4+BaCl2==BaSO4↓+MgCl2,加入的NaOH溶液是为了除去杂质氯化镁,反应为:MgCl2+2NaOH==Mg(OH)2↓+2NaCl,加入的Na2CO3溶液是不仅除去原杂质氯化钙,还除去加入的过量BaCl2溶液,反应为:CaCl2+Na2CO3==CaCO3↓+2NaCl,BaCl2+Na2CO3==BaCO3↓+2NaCl ,A、流程Ⅰ中加入溶液的顺序能改变,氢氧化钠和碳酸钠顺序可以打乱,错误,B、流程Ⅰ将粗盐水中的SO42-、 Mg2+、Ca2+转化为沉淀,正确,C、流程Ⅰ后过滤得到四种沉淀:BaSO4、Mg(OH)2、CaCO3、BaCO3,错误,D、流程Ⅲ中发生的反应是:2NaHCO3 △Na2CO3 + H2O + CO2↑,是分解反应,正确,故选BD 与
②根据化学方程式:NH4HCO3+NaCl NaHCO3↓+NH4Cl中NH4HCO3、NaCl与NaHCO3、NH4Cl的质量关系为79:58.5:84:53.5,向100g水中加入11.7g NaCl和15.8g NH4HCO3,两者恰好完全反应,生成NaHCO3的质量为16.8g,NH4Cl的质量为10.7g,而20℃时,NaHCO3的溶解度为9.7g,NH4Cl的溶解度为37.2g,故理论上从溶液中析出NaHCO3晶体的质量=16.8g -9.7g =7.1g

 快乐5加2金卷系列答案
快乐5加2金卷系列答案