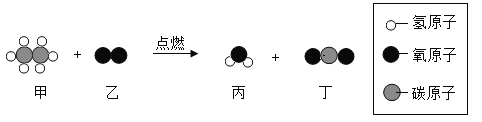
题目内容
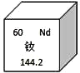
【题目】图甲是锌元素在元素周期表中的相关信息,图乙是锌原子结构示意图,下列说法正确的是

A.图乙中x=8
B.锌在元素周期表中的位置是第四周期
C.锌的相对原子质量为65.38g
D.锌原子在化学变化中容易得到电子
【答案】B
【解析】
根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量;原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。若最外层电子数>4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子。
A、质子数=核外电子数,为原子,则30=2+8+x+2,x=18,故A错误;
B、由锌原子结构示意图结合元素周期律可知,锌原子核外有四个电子层,原子核外的电子层数等于元素所在周期数,故锌元素在元素周期表中的位置是第四周期,故B正确;
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为65.38,相对原子质量单位是“1”,不是“克”,故C错误;
D、锌原子的最外层电子数是2,小于4,在化学反应中易失去2个电子而形成阳离子,故D错误。
故选B。

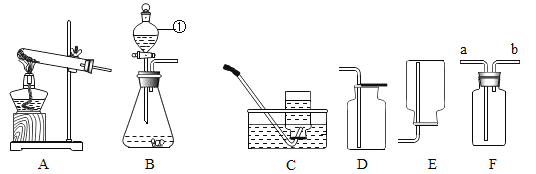
【题目】空气中氧气含量测定的再认识.
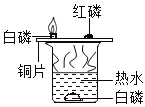
Ⅰ.(实验回顾)如图是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.
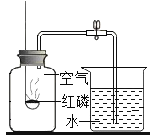
(1)写出红磷燃烧的化学方程式________________,现象是_________.
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内气压减小,烧杯中水倒吸到集气瓶.若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量.
(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大.
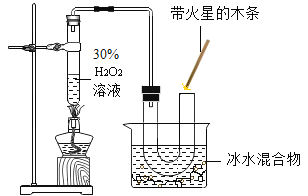
Ⅱ.(实验改进)
根据铁在空气中生锈的原理设计如图实验装置,再次测定空气中氧气含量.装置中饱和食盐水、活性炭会加速铁生锈.测得实验数据如表
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(交流表达)
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式_________.
(2)根据表中数据计算,改进实验后测得的空气中氧气的体积分数是_____(计算结果精确到0.1%).
(3)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是___________;(写一条)
III.四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2Na2S4+O2+2H2O═8S↓+4NaOH
(查阅资料)①Na2S4受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢.
②硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应.
③NaOH溶液可吸收硫化氢和二氧化碳.
(实验过程)
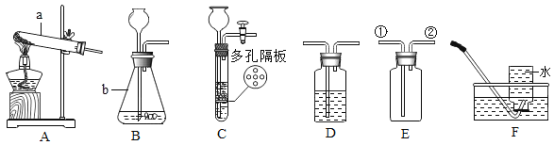
①取0.5g碳酸钠、0.2g硫粉混合后置于试管中,加入(如图①所示,夹持装置已略去),制得Na2S4,反应为:4Na2CO3+12S+X![]() 2Na2S4+2Na2S2O3+4CO2,X的化学式为___________;
2Na2S4+2Na2S2O3+4CO2,X的化学式为___________;
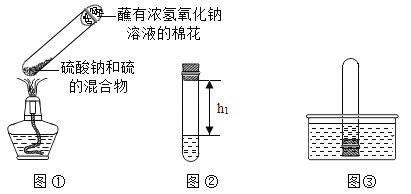
②冷却后,取下棉花,放置一段时间,再向该试管中加入10mL水,迅速塞紧橡胶塞,充分振荡.测量液面至橡胶塞下沿的距离,记录数据h1(如图②所示);
③将该试管插入水中(如图③所示),拔下橡胶塞,观察到_________,塞紧橡胶塞.将试管取出,倒转过来,测量液面至橡胶塞下沿的距离h2,记录数据h2.理论上h2:h1=___________;
④(反思与评价)实验过程①中要塞氢氧化钠溶液的棉花的原因是___________;若实验过程②中,冷却取下棉花后,未放置一段时间即进行后续操作,测定结果_________(填“偏大”、“偏小”或“无影响”),理由是:_______________.