题目内容
【题目】结合下列化学实验装置,回答有关问题。
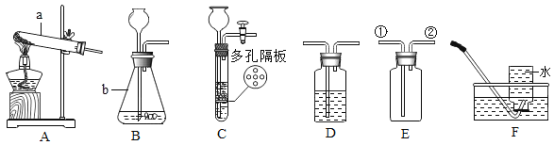
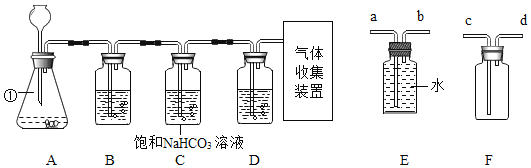
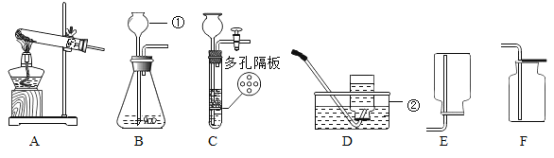
(1)写出图中标有字母的仪器的名称:b____。
(2)实验室用装置A制氧气的化学方程式为_____。
(3)实验室常用装置C代替装置B制取气体,装置C的优点是____。
【答案】锥形瓶 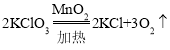 能控制反应的发生和停止。
能控制反应的发生和停止。
【解析】
(1)b的名称为锥形瓶;
(2)实验室用装置A制氧气,该装置是固体加热型装置,试管口没有棉花,所用药品是氯酸钾和二氧化锰,氯酸钾在二氧化锰催化和加热的条件下生成氯化钾和氧气,化学方程式为: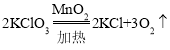 ;
;
(3)在装置C中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入。反应开始后,关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。实验室常用装置C代替装置B制取气体,装置C的优点是可以随时控制反应的发生与停止。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】兴趣小组在课外实验中意外发现:将镁条放入Na2CO3溶液中,快速产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究Ⅰ:反应产生的气体是什么?
(作出猜想)小组同学经查阅资料和讨论,根据化学变化过程中元素不变, 提出如下猜想:
①氢气;
②二氧化碳;
③氢气和二氧化碳。
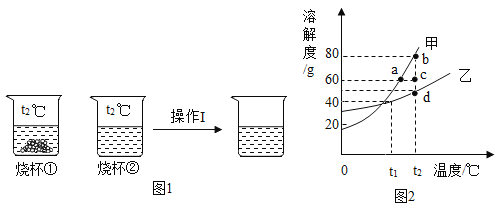
(实验1)取5g打磨后的镁条、100 mL Na2CO3溶液于装置A中,按图1所示方案进行实验。观察到的现象是_________,说明猜想①正确。
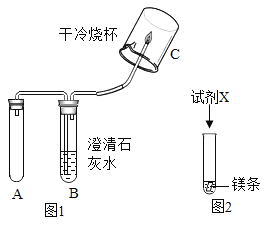
探究Ⅱ:快速产生气体的原因是什么?
(查阅资料)镁与水缓慢反应生成氢气; Na2CO3溶液显碱性,其溶液中除Na+、CO![]() 外,还有OH-。
外,还有OH-。
(作出猜想)可能是Na2CO3溶液中的某一种离子促进了镁与水的反应。
(实验2)将等质量的镁条按照图2进行如下如下实验。
实验序号 | a | b | c |
溶液(浓度相同) | H2O | Na2CO3 | NaOH |
30min时产生气体体积(mL) | <0.2 | 0.7 | <0.2 |
气体的主要成分 | H2 | ||
30min时镁条表面情况 | 大量白色固体附着 | ||
(1)实验2中a组实验的作用是_______
(2)探究2中能够说明CO![]() 对Mg与水反应起促进作用的证据是____。
对Mg与水反应起促进作用的证据是____。
探究3:反应产生的白色沉淀中是否含有MgCO3?
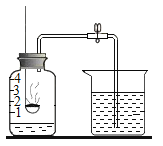
(实验3)利用如图装置证明样品中含有MgCO3(夹持仪器略去)。
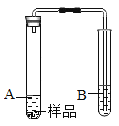
(1)所需要的试剂分别是:A___、B_____。
(2)实验中观察到的现象有___反思交流:有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。