题目内容
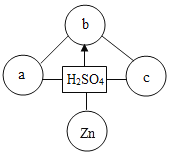
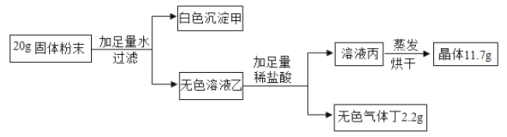
【题目】现有一包固体粉末,可能由CaCO3、CaO、Na2CO3中的一种或几种组成,为确定其成分,按下列流程进行实验。
(1)根据复分解反应发生的条件,判断下列反应不能发生的是(_____)
A 碳酸钠溶液和氢氧化钙溶液 B 氢氧化钠溶液和氯化钾溶液
C 盐酸和硫酸铜溶液 D 硝酸钾溶液和稀盐酸
(2)写出框图中白色沉淀甲的化学式为_______。
(3)写出框图中生成无色气体丁的化学反应方程式________。
(4)原固体中一定含有的物质是____________(填化学式)。
【答案】BCD CaCO3 Na2CO3+2HCl=2NaCl+ H2O +CO2↑ CaCO3、CaO、Na2CO3
【解析】
复分解反应的发生条件,两物质交换成分生成物中必须有沉淀、气体或水,反应才能进行。
(1)A、碳酸钠溶液和氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,两物质交换成分生成物中且有沉淀生成,属于复分解反应,不符合题意;
B、氢氧化钠溶液和氯化钾溶液相互交换成分,得不到气体、沉淀或水,故反应不能进行,符合题意;
C、盐酸和硫酸铜溶液相互交换成分,得不到气体、沉淀或水,故反应不能进行,符合题意;
D、稀盐酸和硝酸钾相互交换成分,得不到气体、沉淀或水,故反应不能进行,符合题意。故选BCD。
(2)20g固体粉末加水过滤,得到白色沉淀甲和无色溶液乙,根据所给的CaCO3、CaO、Na2CO3物质,碳酸钙不溶于水,氧化钙和水反应生成氢氧化钙,碳酸钠易溶于水,可知该白色沉淀甲应该为碳酸钙,化学式为CaCO3;
(3)向其中加入足量的稀盐酸,有气泡冒出,说明溶液中含有碳酸钠,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(4)根据(2)(3)可知,原固体中一定含有碳酸钠和碳酸钙。由于无色溶液中含有碳酸钠,假设原固体没有氧化钙,则溶于水后也没有氢氧化钙生成,则最终生成的11.7g晶体是氯化钠,设生成2.2g二氧化碳同时生成氯化钠的质量为![]() ,
,
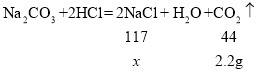
![]()
![]()
所以其他氯化钠是氢氧化钠和盐酸反应生成的,溶液中的氢氧化钠是碳酸钠和氢氧化钙反应生成的,氢氧化钙是氧化钙和水反应生成的,所以原固体中含有CaCO3、CaO、Na2CO3三种物质。

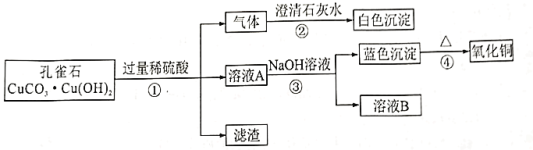
【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。某兴趣小组对硫酸的性质、制取、用途等方面的探究,请你共同参与并回答有关问题。
(探究一)硫酸的性质
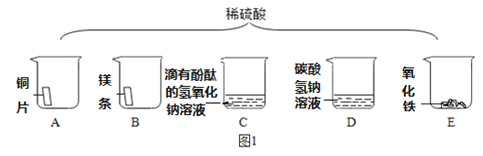
(1)如图1将足量的稀硫酸分别加入A~E五只烧杯中。无现象的是_____________(填序号)。
(2)烧杯C中的现象是红色褪去,反应后溶液中溶质是什么呢?(无色酚酞不考虑)
(猜想)猜想一:只有Na2SO4 ; 猜想二:有_________________;
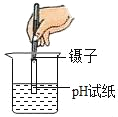
(3)为了验证猜想,小组同学取烧杯中的溶液,并选用老师提供的pH试纸、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,比照比色卡,pH<7 | ____________ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,小组同学一致确定猜想二是正确的。
(评价反思)老师指出上述三个实验探究中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
①实验操作中明显的一处错误是_________________________________________;
②实验探究方案中也有一个是不合理的,不合理的原因是____________________________。
(探究二)硫酸的工业制法
工业上以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程如图所示,其中沸腾炉内发生的主
要反应是: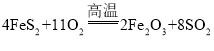

(1)接触室中发生的化学方程式为_________________________________________。
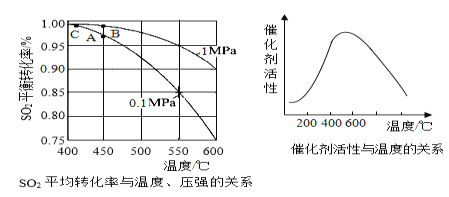
(2)接触室中的SO2平衡转化率与温度及压强的关系如下图所示,催化剂活性与温度的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图中A点),而没有选择SO2转化率更高的C点对应的反应条件,其原因是___________________________________。
(探究三)探究某黄铁矿中FeS2的含量。
(查阅资料)![]()
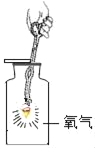
(实验探究)Ⅰ称取1.60g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应(同工业上沸腾炉内的反应)。

Ⅱ反应结束后,将乙瓶中的溶液进行如下图处理。

(问题讨论)I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是_____________________。
(含量测定)计算该黄铁矿中FeS2的质量分数为_______________。(写出计算过程)