题目内容
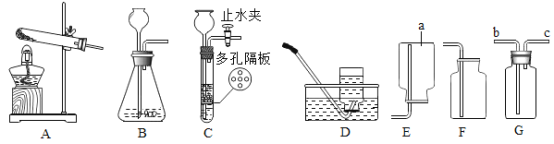
【题目】小樱同学用如图所示装置,分别进行“燃烧条件”和“氧气性质”的探究实验(已如:白磷的着火点为40℃),请回答下列问题。
内容步骤 | (实验1)燃烧条件 | (实验2)氧气性质 |
步骤1 | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞; | 烧杯中盛有Ca(OH)2溶液,燃烧匙中放入木炭,点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞; |
步骤2 | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
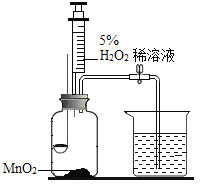
(1)H2O2与MnO2接触时,发生反应的化学方程式为________,MnO2的作用是______。
(2)实验1中,推入H2O2溶液,燃烧匙和水中的白磷均不燃烧,燃烧匙中的白磷不燃烧的原因是______;水中的白磷不燃烧的原因是_______。打开止水夹,烧杯中观察到的现象是______。
(3)实验2中,打开止水夹,推入H2O2溶液,观察到木炭燃烧得更剧烈,由此得出氧气的性质是______,木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶中,集气瓶中观察到的现象是______。
【答案】 催化作用 温度没有达到可燃物的着火点 没有与氧气接触 导管口有气泡冒出,白磷燃烧 具有助燃性 溶液变浑浊
催化作用 温度没有达到可燃物的着火点 没有与氧气接触 导管口有气泡冒出,白磷燃烧 具有助燃性 溶液变浑浊
【解析】
(1)过氧化氢能在二氧化锰的催化下分解为水和氧气,该反应的化学方程式为: ;
;
在该反应中,二氧化锰是催化剂,起到催化的作用;
(2)燃烧匙中的白磷与空气接触,不能燃烧是因为温度没有达到可燃物的着火点;烧杯中水的温度为80℃,温度达到了白磷的着火点,但是隔绝了空气,不能燃烧,故填:温度没有达到可燃物的着火点,没有与氧气接触;
打开止水夹,过氧化氢在二氧化锰的催化下反应生成的氧气通过导管进入烧杯中,故导管口有气泡冒出,导管口的白磷与氧气接触,温度达到了白磷的着火点,白磷燃烧,故烧杯中观察到的现象是:导管口有气泡冒出,白磷燃烧;
(3)实验2中,打开止水夹,推入H2O2溶液,观察到木炭燃烧得更剧烈,过氧化氢在二氧化锰的催化下分解为水和氧气,木炭燃烧的更剧烈,说明氧气具有助燃性;
木炭在氧气中燃烧,生成二氧化碳,生成的二氧化碳与烧杯中氢氧化钙反应生成碳酸钙和水,使装置内压强减小,木炭熄灭后冷却一段时间,在外界大气压的作用下,烧杯中的部分氢氧化钙溶液流入集气瓶中,由于集气瓶中含有二氧化碳,二氧化碳能与氢氧化钙反应生成碳酸钙和水,故集气瓶中观察到的现象是:溶液变浑浊。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】(1)某化学兴趣小组的同学向无水乙醇中放入一小块金属钠,观察到有气泡产生。小组同学对这一现象产生了兴趣,进行了如下探究
(提出问题)无水乙醇和金属钠反应产生的气体是什么?
(查阅资料)I无水乙醇(CH3CH2OH)和金属钠反应生成乙醇钠CH3CH2ONa)和一种常见的可燃性气体;
Ⅱ浓硫酸具有较强的吸水性,可用作某些气体的干燥剂,比
Ⅲ白色的无水硫酸铜粉末遇水后会变成蓝色。
(猜想与假设)猜想一:CO;猜想二:CH4;猜想三:H2。兴趣小组的同学提出上述猜想的理论依据是_______________
(设计并实验)兴趣小组的同学分成甲、乙两组设计实验方案进行探究。
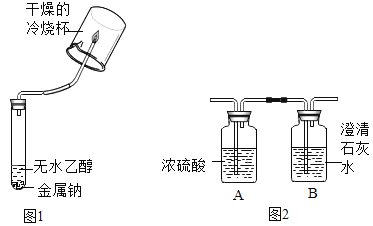
①甲组同学设计的实验方案如下:
实验操作 | 实验现象 | 实验结论 |
将反应产生的气体点燃在火焰上方罩一个干燥的冷烧杯 | 烧杯内壁有小液滴生成 | 猜想三成立 |
②乙组同学认为只完成上述实验猜想二也可能成立理由是 _________,并设计了如下实验进一步验证:将反应产生的气体点燃,燃烧产物依次通人A、B装置(如图2),测得A装置中质量增大,B装置中质量不变乙组的同学根据实验数据分析,证明猜想_________成立
(得出结论)无水乙醇与金属钠反应的化学方程式为_____________;该反应的基本反应类型是____________。
(实验反思)甲组同学受到乙组同学的启发认为只需要增加一个实验:再在火焰上方罩一个内壁蘸有澄清石灰水的烧杯,观察现象,就能使本组的实验方案更加完善。你认为此方案________ (选填“合理”或“不合理”)。
(拓展延伸)要确认该实验过程中所用的乙醇是无水乙醇的实验方法是____________。
(2)小明同学为了测定实验室中一瓶标签破损的硫酸的溶质质量分数,他取20g该硫酸于烧杯中,向其中加入10g锌粉(锌粉过量),完全反应后测得烧杯内物质的总质量为29.9g。该瓶硫酸的溶质质量分数是___________?