题目内容
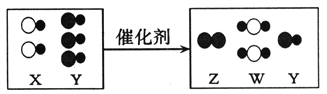
【题目】有A、B、R三种元素,在空气中A的单质约占总体积的21%,B元素能与A元素组成相对分子质量最小的氧化物,该氧化物在常温下常压下为无色无味的液体,R元素的单质能在A元素的单质中燃烧,发出蓝紫色火焰,生成一种对大气有污染的气体D。请回答下列问题:
(1)A的元素符号为______,B的名称为______;
(2)D中R元素的化合价为______价。
(3)写出单质R与单质A反应的符号表达式______,该反应的基本反应类型是______。
【答案】O 氢元素 +4 ![]() 化合反应
化合反应
【解析】
因在空气中A的单质约占总体积的21%,氧气约占总体积的21%,所以A为氧元素.又知B元素能与A元素组成相对分子质量最小的氧化物,水为相对分子质量最小的氧化物,所以B为氢元素.R元素的单质能在A元素的单质中燃烧,发出蓝紫色火焰,生成一种对大气有污染的气体D,所以R为硫元素,D为二氧化硫。
根据以上分析可知:
(1)A的元素符号为O,B的名称为氢元素;
(2)D是二氧化硫,二氧化硫中S元素的化合价为+4价;
(3)单质R与单质A的反应是硫与氧气反应生成二氧化硫,反应的符号表达式为:![]() ,该反应是由两种物质生成一种物质的反应,基本反应类型是化合反应。
,该反应是由两种物质生成一种物质的反应,基本反应类型是化合反应。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】水是生命的源泉,也是不可缺少的资源。
(1)某矿泉水的主要矿物质成分及含量如下表:
成分 | Ca | K | Mg | Na |
含量(mg/L) | ≥4 | ≥0.4 | ≥0.5 | ≥0.8 |
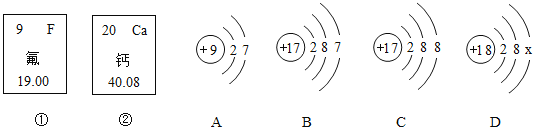
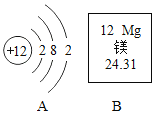
这里含有的Ca、K、Mg、Na是指_____(填“单质、元素、分子或原子”)。
(2)自然界中的水含有许多可溶性和不溶性杂质,通过多种途径都可以使水得到净化,下图是自来水厂净化水过程示意图。
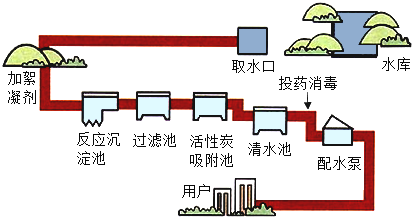
(Ⅰ)自来水厂使用的净化水的方法主要有:沉淀、_____、_____、消毒等。
(Ⅱ)生活中,通过煮沸既能降低自来水的硬度,又能杀菌消毒,但也会造成壶中出现水垢,原因是烧水时自来水中的少量Ca(HCO3)2发生分解,生成难溶性的碳酸钙和二氧化碳等物质,请写出Ca(HCO3)2受热分解的化学方程式_____。
(Ⅲ)下列做法会造成水体污染的是_____(填序号)。
A 工业废水直接排放
B 生活污水集中处理后排放
C 禁止使用含磷洗衣粉
D 大量使用化肥、农药
(3)电解水实验揭示了水的组成,理论依据是_____。
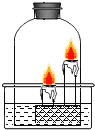
【题目】小樱同学用如图所示装置,分别进行“燃烧条件”和“氧气性质”的探究实验(已如:白磷的着火点为40℃),请回答下列问题。
内容步骤 | (实验1)燃烧条件 | (实验2)氧气性质 |
步骤1 | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞; | 烧杯中盛有Ca(OH)2溶液,燃烧匙中放入木炭,点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞; |
步骤2 | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
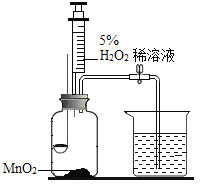
(1)H2O2与MnO2接触时,发生反应的化学方程式为________,MnO2的作用是______。
(2)实验1中,推入H2O2溶液,燃烧匙和水中的白磷均不燃烧,燃烧匙中的白磷不燃烧的原因是______;水中的白磷不燃烧的原因是_______。打开止水夹,烧杯中观察到的现象是______。
(3)实验2中,打开止水夹,推入H2O2溶液,观察到木炭燃烧得更剧烈,由此得出氧气的性质是______,木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶中,集气瓶中观察到的现象是______。