题目内容
小华想测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器.(1)你认为能测出铜的质量分数的是______合金.
(2)小华取该合金的粉末32.5g与足量该硫酸充分反应,经测定产牛了0.4g气体.求该合金中铜的质量分数.
【答案】分析:(1)两种金属中一种金属的活动性比氢强,一种金属的活动性比氢弱,只有满足此条件才能测定出铜的质量分数.
(2)根据氢气的质量求出锌的质量,再用合金质量减去锌的质量即为铜的质量;再用合金中铜的质量除以合金的质量乘以百分之百既得合金中铜的质量分数.
解答:解:(1)铜的活动性比氢弱,不与稀酸发生反应,锌的活动性比氢强,能与稀酸发生反应,因而铜锌合金能测定出铜的质量分数;而银的活动性比氢弱,也不与稀酸发生反应,因而铜银合金不能测定出铜的质量分数.
故答案为:Cu~Zn
(2)设:合金中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
 =
=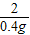 ,x=13g
,x=13g
合金中铜的质量为:32.5g-13g=19.5g
合金中铜的质量分数=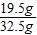 ×100%=60%
×100%=60%
答:合金中铜的质量分数为60%.
点评:稀盐酸是混合物,其溶质是氯化氢气体,在做有关化学方程式的计算时,不能把稀盐酸的质量当成反应物的质量直接代入计算.
(2)根据氢气的质量求出锌的质量,再用合金质量减去锌的质量即为铜的质量;再用合金中铜的质量除以合金的质量乘以百分之百既得合金中铜的质量分数.
解答:解:(1)铜的活动性比氢弱,不与稀酸发生反应,锌的活动性比氢强,能与稀酸发生反应,因而铜锌合金能测定出铜的质量分数;而银的活动性比氢弱,也不与稀酸发生反应,因而铜银合金不能测定出铜的质量分数.
故答案为:Cu~Zn
(2)设:合金中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
 =
=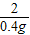 ,x=13g
,x=13g合金中铜的质量为:32.5g-13g=19.5g
合金中铜的质量分数=
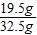 ×100%=60%
×100%=60% 答:合金中铜的质量分数为60%.
点评:稀盐酸是混合物,其溶质是氯化氢气体,在做有关化学方程式的计算时,不能把稀盐酸的质量当成反应物的质量直接代入计算.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
小华想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器.
(1)根据现有的条件,你认为只能测出 合金中铜的质量分数;
(2)为了测定该合金的组成,小华称取10g该合金粉末,在粉末中连续三次加入稀盐酸反应.每加一次盐酸,小华记录所得气体的质量,实验数据如下:
(3)从上表数据分析,小华用10g合金粉末总共收集到 g氢气;
(4)求出该合金中铜的质量分数.
(1)根据现有的条件,你认为只能测出
(2)为了测定该合金的组成,小华称取10g该合金粉末,在粉末中连续三次加入稀盐酸反应.每加一次盐酸,小华记录所得气体的质量,实验数据如下:
| 第一次 | 第二次 | 第三次 | |
| 连续加入盐酸的体积(ml) | 10 | 10 | 10 |
| 生成氢气的质量(g) | 0.08 | 0.08 | 0.04 |
(4)求出该合金中铜的质量分数.