题目内容
【题目】完成下列基础化学实验。
Ⅰ.根据下列实验装置图,回答有关问题:
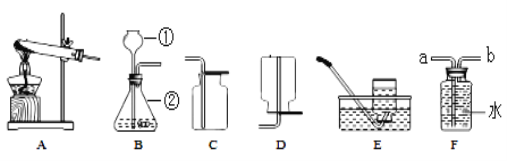
(1)写出装置图中标号仪器的名称:①_____________,②___________。
(2)实验室用氯酸钾和二氧化锰制取氧气的化学方程式为________________________,可选用的发生装置是______。如用E装置收集氧气,当集气瓶中的水排完之后,_______________,缓慢的移出水槽,正放在桌子上。
(3)实验室用大理石和稀盐酸制取二氧化碳时的化学方程式为_______________。
(4)选用F收集氢气时,氢气应从__________(填“a”或“b”)端进入。
Ⅱ.如何证明盐酸与碱发生了化学反应?某化学兴趣小组做了如下两个实验。
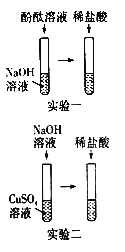
实验一:向NaOH溶液中滴入几滴酚酞溶液,振荡,继续加入稀盐酸,观察到__________________,可证明盐酸与氢氧化钠能发生反应。
实验二:向CuSO4溶液中滴入NaOH溶液,观察到的反应现象为___________;继续滴加稀盐酸,看到_____________(反应现象),也证明了盐酸与碱能发生反应。
实验结束后,小组同学对实验一中试管内的无色溶液成分展开了讨论。
【提出问题】实验一结束后,试管内的溶液的溶质除酚酞外还有什么?
【猜想假设】猜想一:NaCl和HCl 猜想二:NaCl
【实验设计】若要证明猜想一成立,下列试剂中不能达到实验目的的是_________。
A.紫色石蕊溶液 B.Cu C.AgNO3 D.Na2CO3
【讨论交流】小莹同学认为滴入NaOH溶液,也能证明猜想一成立,你认为小莹同学的方案是否可行并说明理由____________________。
【答案】 长颈漏斗 锥形瓶 2KClO3△2KCl + 3O2↑ A 在水下盖上玻璃片 CaCO3 + 2HCl=CaCl2 + H2O + CO2↑ b 溶液由红色变成无色 溶液中产生蓝色沉淀 【答题空10】蓝色沉淀消失,溶液由无色变成蓝色 B、 C 可行,因为若能观察到溶液没有立即变红就可以证明猜想一成立。(其他类似描述也可以)
【解析】Ⅰ.(1)仪器①是长颈漏斗,仪器②是锥形瓶;
(2)氯酸钾在二氧化锰的催化下加热生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑;属于固固加热型,所以选装置A;若用E装置来收集氧气,待集气瓶中的水排完以后,应当在水下面用玻璃片盖住瓶口,小心地把集气瓶移出水槽,正放在桌面上,因为氧气的密度比空气的密度大;
2KCl+3O2↑;属于固固加热型,所以选装置A;若用E装置来收集氧气,待集气瓶中的水排完以后,应当在水下面用玻璃片盖住瓶口,小心地把集气瓶移出水槽,正放在桌面上,因为氧气的密度比空气的密度大;
(3)大理石(主要成分是碳酸钙)和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3 + 2HCl=CaCl2 + H2O + CO2↑;
(4)氢气的密度比水小,用该装置收集氢气应从b端进入;
Ⅱ. (1)NaOH溶液显碱性,滴入几滴酚酞溶液,向NaOH溶液中滴入几滴酚酞溶液,振荡,变红色,继续加入稀盐酸,观察到溶液由红色,说明碱性物质消失,由此现象证明了盐酸与氢氧化钠能发生反应;
(2)CuSO4溶液与NaOH溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,观察到的现象为有蓝色沉淀生成;继续滴加稀盐酸,氢氧化铜沉淀能与稀盐酸反应生成氯化铜和水,反应的现象,通过稀盐酸与氢氧化铜反应的现象(蓝色沉淀消失),证明了盐酸与氢氧化钠能发生反应;
【实验设计】若要证明猜想一成立,即证明是否有盐酸存在,盐酸能使紫色石蕊溶液变红色,能与碳酸钠反应生成二氧化碳气体;不能与铜反应,能与硝酸银溶液反应生成氯化银白色沉淀,但氯化钠也能与硝酸银溶液反应,不能证明是否有盐酸存在;
【讨论交流】氢氧化钠溶液遇无色酚酞溶液变红色,滴入NaOH溶液,若没有立即变红,说明存在稀盐酸,稀盐酸与氢氧化钠溶液反应生成氯化钠和水,则说明猜想一成立(合理即可)。
点睛;
实验装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化学反应等因素。

【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
物质 | A | B | C | D |
反应前质量/g | 1.7 | 2.2 | 7.9 | 0.9 |
反应后质量/g | 待测 | 6.6 | 0 | 2.7 |
则反应后A的质量为___________;该反应中B和D两种物质变化的质量比为_______。