题目内容
【题目】废旧酸性锌锰干电池结构及主要成分示意如图。
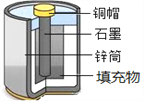

某兴趣小组拟采用如下方法回收其中的几种物质。试回答下列问题。
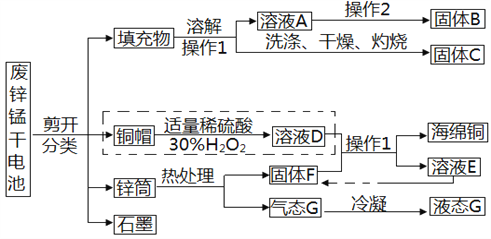
(1)回收废旧干电池可以减少固体废弃物和_________________________对环境的污染。
(2)实验室进行操作1时,用到的玻璃仪器有:烧杯、玻璃棒、_______________。
(3)固体B回收后常用作化肥,则检验固体B中阳离子的方法是:_____________________。
(4)回收过程中要除去溶液D中过量的H2O2后才能进行后续操作,如利用流程中的物质达到此目的,操作过程是:_______________________________________。
虚线框里发生反应的方程式为:____________________________________。
请另设计一种方案完成虚线框内流程:________________________________________。
【答案】 重金属离子 漏斗 取样,加氢氧化钠(碱)溶液,加热,生成使湿润的红色石蕊试纸变蓝的气体 加入固体C直到无气体产生,过滤 Cu+H2O2+H2SO4== CuSO4+2H2O 在空气中充分灼烧后再加适量稀硫酸
【解析】(1)废旧干电池含有重金属离子,回收可以减少重金属离子对环境的污染。
(2)操作1将固体和液体分开,所以操作1是过滤,用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(3)干电池的填充物中含有氯化铵,溶解后进入溶液A,所以固体B用作化肥,为氯化铵,验证铵根离子可以,取样,加氢氧化钠(碱)溶液,加热,生成使湿润的红色石蕊试纸变蓝的气体;
(4)过氧化氢在二氧化锰的催化下生成水和氧气,所以要除去溶液D中过量的H2O2,可以加入固体C直到无气体产生,过滤;铜与过氧化氢及硫酸反应生成硫酸铜和水,化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O;也可以将铜帽在空气中充分灼烧后再加适量稀硫酸,得到硫酸铜。

 名校课堂系列答案
名校课堂系列答案【题目】某班同学在做《基础实验8》中碱的化学性质时,发现将NaOH固体溶于水后的溶液与CuS04溶液反应时出现了三种实验现象:蓝色絮状沉淀、浅绿色沉淀、亮蓝色溶液。产生蓝色絮状沉淀时的反应方程式为_______________________________________。对于异常实验现象,
同学们展开研究性学习。
【提出问题】实验中产生异常现象的原因是什么?
【初步探究】甲同学将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中。实验现象如下:
滴加CuSO4溶液的量 | 实验现象 |
第1~6滴 | 产生蓝色沉淀,振荡后沉淀消失,形成亮蓝色溶液。 |
第7~9滴 | 产生蓝色沉淀,振荡后沉淀不消失,沉淀逐渐增多。 |
第10~20滴 | 蓝色沉淀不再增加,振荡后沉淀逐渐变为浅绿色。 |
【实验结论】_____________________________是实验出现“异常”的主要因素。
【再次探究】两种异常现象产物是什么?
【查阅资料】
①碱式硫酸铜是一种浅绿色固体,化学式可表示为aCuSO4·bCu(OH)2难溶于水,在酸溶液中可发生反应生成Cu2+、SO42—和H2O。加热时能分解生成氧化铜、非金属氧化物和氧气。
②铜酸钠[Na2Cu(OH)4]能溶于水,溶液呈亮蓝色。该溶液不稳定,久置或加热易生成氧化铜沉淀。
③碱式硫酸铜、氢氧化铜、铜酸钠之间可逐步转化。
【猜想假设】
Ⅰ.Cu(OH)2在NaOH溶液中溶解生成铜酸钠。
Ⅱ.实验中形成浅绿色沉淀是碱式硫酸铜。
【实验探究】
Ⅰ.乙同学向Cu(OH)2中加入过量饱和NaOH溶液,沉淀溶解,滴加少量稀硫酸,出现黑色沉淀。
Ⅱ.丙同学取出实验中浅绿色固体,分成等质量两份,一份高温灼烧后只得到1.6gCuO固体,另一份滴加10%的稀盐酸至恰好完全反应,共用去盐酸10.95g。
【结论解释】猜想Ⅰ成立。出现黑色沉淀原因是________________________________。
猜想II成立。a:b=________________。
【实验反思】丁同学按照书本要求向2mLCuSO4溶液中逐滴加入稀氢氧化钠溶液,始终未形成亮蓝色溶液,说明实验现象还与______________________有关,实验时要遵守实验要求。