题目内容
 已知甲、乙分别是稀硫酸和氢氧化钠溶液中的一种.某化学兴趣小组的同学在探究甲和乙溶液进行中和反应时,测得反应过程中溶液酸碱度变化及相关数据如图所示.试根据要求,回答下列问题:
已知甲、乙分别是稀硫酸和氢氧化钠溶液中的一种.某化学兴趣小组的同学在探究甲和乙溶液进行中和反应时,测得反应过程中溶液酸碱度变化及相关数据如图所示.试根据要求,回答下列问题:(1)根据此变化曲线,你认为甲溶液中的溶质是
H2SO4
H2SO4
.(写化学式)(2)当加入甲溶液的质量是5g时,滴入无色酚酞试液,溶液呈
红色
红色
色,此时,溶液中的溶质为NaOH、Na2SO4
NaOH、Na2SO4
.(写化学式)(3)当加入甲溶液的质量是15g时,向此时溶液中加入下列试剂,不会出现明显实验现象的是
③
③
(填写下列各项的序号).①碳酸钠粉末 ②氯化钡溶液
③氢氧化钾溶液 ④石蕊试液
(4)求恰好完全反应时溶液中溶质的质量.(写出相应计算过程)
分析:(1)根据图象可知:原溶液pH>7,因此是把稀硫酸滴入氢氧化钠溶液中;
(2)根据图象可知,当加入甲溶液的质量是5g时,pH>7,溶液中氢氧化钠未完全反应,加入的硫酸是不足量的,据此分析溶液中的溶质;
(3)根据图象可知,当加入甲溶液的质量是15g时,pH<7,溶液中氢氧化钠完全反应,加入的硫酸是过量的,据此分析有关的问题;
(4)根据图象可知,当加入甲溶液的质量是10g时,氢氧化钠与加入的硫酸恰好完全反应,再根据标签中的数据及反应的方程式即可计算溶液中溶质的质量
(2)根据图象可知,当加入甲溶液的质量是5g时,pH>7,溶液中氢氧化钠未完全反应,加入的硫酸是不足量的,据此分析溶液中的溶质;
(3)根据图象可知,当加入甲溶液的质量是15g时,pH<7,溶液中氢氧化钠完全反应,加入的硫酸是过量的,据此分析有关的问题;
(4)根据图象可知,当加入甲溶液的质量是10g时,氢氧化钠与加入的硫酸恰好完全反应,再根据标签中的数据及反应的方程式即可计算溶液中溶质的质量
解答:解:(1)由图象可知:原溶液pH>7,因此是把稀硫酸滴入氢氧化钠溶液中.所以,甲溶液中的溶质是H2SO4;
(2)由图象可知,当加入甲溶液的质量是5g时,pH>7,溶液中氢氧化钠未完全反应,加入的硫酸是不足量的,溶液中的溶质有NaOH、Na2SO4;
(3)由图象可知,当加入甲溶液的质量是15g时,pH<7,溶液中氢氧化钠完全反应,加入的硫酸是过量的.硫酸与碳酸钠粉末反应有气泡生成,与氯化钡溶液反应有白色沉淀生成,能使石蕊试液变红,与氢氧化钾溶液反应没有明显的现象;
(4)由图象可知,当加入甲溶液的质量是10g时,氢氧化钠与加入的硫酸恰好完全反应.
设好完全反应时溶液中溶质的质量为X
2NaOH+H2SO4 =2H2O+Na2SO4
98 142
10g×19.6% X
=
解得:X=3.04
故答为:(1)H2SO4;(2)红色,NaOH、Na2SO4;(3)③;(4)恰好完全反应时溶液中溶质的质量是3.04g.
(2)由图象可知,当加入甲溶液的质量是5g时,pH>7,溶液中氢氧化钠未完全反应,加入的硫酸是不足量的,溶液中的溶质有NaOH、Na2SO4;
(3)由图象可知,当加入甲溶液的质量是15g时,pH<7,溶液中氢氧化钠完全反应,加入的硫酸是过量的.硫酸与碳酸钠粉末反应有气泡生成,与氯化钡溶液反应有白色沉淀生成,能使石蕊试液变红,与氢氧化钾溶液反应没有明显的现象;
(4)由图象可知,当加入甲溶液的质量是10g时,氢氧化钠与加入的硫酸恰好完全反应.
设好完全反应时溶液中溶质的质量为X
2NaOH+H2SO4 =2H2O+Na2SO4
98 142
10g×19.6% X
| 98 |
| 142 |
| 10g×19.6% |
| x |
故答为:(1)H2SO4;(2)红色,NaOH、Na2SO4;(3)③;(4)恰好完全反应时溶液中溶质的质量是3.04g.
点评:本题以图象的形式考查了酸碱中和反应时溶液pH的变化,以及物质间的质量关系,完成此题,可以依据已有的知识进行;有关的计算要准确.

练习册系列答案
相关题目
 23、如图表示:向盛有10mL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
23、如图表示:向盛有10mL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题: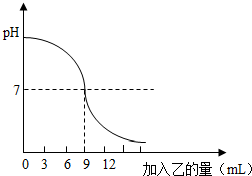 如图表示:向盛有lOmL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
如图表示:向盛有lOmL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题: 已知甲、乙分别是稀硫酸和氢氧化钠溶液中的一种.某化学兴趣小组的同学在探究甲和乙溶液进行中和反应时,测得反应过程中溶液酸碱度变化及相关数据如图所示.试根据要求,回答下列问题:
已知甲、乙分别是稀硫酸和氢氧化钠溶液中的一种.某化学兴趣小组的同学在探究甲和乙溶液进行中和反应时,测得反应过程中溶液酸碱度变化及相关数据如图所示.试根据要求,回答下列问题: