题目内容
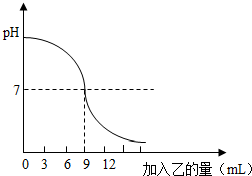 如图表示:向盛有lOmL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
如图表示:向盛有lOmL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:(1)甲是
(2)当加入乙溶液的体积为
(3)当溶液的pH=1.4时,溶液中的溶质是
(4)取盐酸“废液”样品20mL,用10%的氢氧化钠溶液进行测定,当加入氢氧化钠溶液的质量为8g时,“废液”中的盐酸恰好完全中和,测得溶液的pH刚好等于7,计算20mL“废液”样品中所含HCl的物质的量是多少?(列式计算)
分析:根据已有的知识进行分析,碱溶液的pH大于7,酸溶液的pH小于7,恰好完全反应时,溶液呈中性,pH等于7,根据氢氧化钠和盐酸反应的化学方程式即可求得参加反应的盐酸的质量,从而求得所含氯化氢的物质的量.
解答:解:(1)开始时溶液的pH大于7,故甲是氢氧化钠溶液,故填:氢氧化钠;
(2)据图可知,当加入的盐酸的量为9mL时,溶液的pH等于7,此时二者恰好完全反应,故填:9;
(3)氢氧化钠能和盐酸反应生成氯化钠和水,pH=1.4时,盐酸过量,故溶液中的溶质是氯化氢和氯化钠,故填:氯化钠和氯化氢;
(4)恰好完全反应时所用氢氧化钠的物质的量为:
=0.02mol
设样品中所含HCl的物质的量为x
NaOH+HCl═NaCl+H2O
1 1
0.02mol x
=
,x=0.02mol
答:样品中所含HCl的物质的量为0.02mol.
(2)据图可知,当加入的盐酸的量为9mL时,溶液的pH等于7,此时二者恰好完全反应,故填:9;
(3)氢氧化钠能和盐酸反应生成氯化钠和水,pH=1.4时,盐酸过量,故溶液中的溶质是氯化氢和氯化钠,故填:氯化钠和氯化氢;
(4)恰好完全反应时所用氢氧化钠的物质的量为:
| 8g×10% |
| 40g/mol |
设样品中所含HCl的物质的量为x
NaOH+HCl═NaCl+H2O
1 1
0.02mol x
| 1 |
| 0.02mol |
| 1 |
| x |
答:样品中所含HCl的物质的量为0.02mol.
点评:本题考查了酸碱中和的知识以及根据化学方程式的计算,完成此题,可以依据酸碱的性质进行.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
 23、如图表示:向盛有10mL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
23、如图表示:向盛有10mL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题: 如图表示:向盛有lOmL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
如图表示:向盛有lOmL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题: 如图表示:向盛有10mL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
如图表示:向盛有10mL稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题: