题目内容
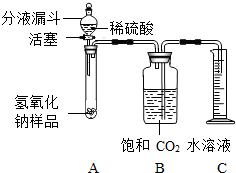
 某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行,实验步骤如下:
某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行,实验步骤如下:①按图连接好装置;
②用天平准确称取氢氧化钠样品2g,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和二氧化碳水溶液220mL.
请回答下列问题:
(1)写出氢氧化钠发生变质的化学方程式:
2NaOH+CO2═Na2CO3+H2O
2NaOH+CO2═Na2CO3+H2O
;(2)在实验步骤1和2之间,还缺少一实验步骤,该实验步骤是:
检查装置的气密性
检查装置的气密性
;(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是:
避免二氧化碳溶解在水里而损耗,造成测定结果偏低
避免二氧化碳溶解在水里而损耗,造成测定结果偏低
;(4)判断实验步骤3中滴入的稀硫酸已过量的标志是:
滴加稀硫酸无气泡产生
滴加稀硫酸无气泡产生
;(5)氢氧化钠样品中碳酸钠的质量分数为:
47.7%
47.7%
(在27℃,101kPa时二氧化碳的密度为1.8g/L;二氧化碳的体积等于排出的饱和二氧化碳水溶液的体积.)(6)叙述检验氢氧化钠部分变质的方法:
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一: 取样,溶于水,滴加 过量的氯化钙溶液 取样,溶于水,滴加 过量的氯化钙溶液 |
有白色沉淀产生 有白色沉淀产生 |
氢氧化钠部分变质 |
| 步骤二: 静置,向上清液中滴加 酚酞 静置,向上清液中滴加 酚酞 |
变红 变红 |
分析:(1)氢氧化钠如果变质会生成碳酸钠,知反应物和生成物正确书写化学方程式.
(2)做实验时连接好仪器一定要检查装置的气密性.
(3)根据实验目的“通过测二氧化碳的体积来计算药品中碳酸钠的含量”进行分析,
(4)证明过量,实际就是证明碳酸钠反应完.
(5)量筒中收集到饱和二氧化碳水溶液220mL即为反应生成的二氧化碳的体积,由此,生成二氧化碳的质量为:220 mL/1000×1.8 g/L=0.396 g.根据二氧化碳的质量及反应的化学方程式便可求出碳酸钠的质量,就能得出样品中碳酸钠的质量分数.
(6)氢氧化钠部分变质,故既要鉴定含有碳酸钠又要鉴定含有氢氧化钠.
(2)做实验时连接好仪器一定要检查装置的气密性.
(3)根据实验目的“通过测二氧化碳的体积来计算药品中碳酸钠的含量”进行分析,
(4)证明过量,实际就是证明碳酸钠反应完.
(5)量筒中收集到饱和二氧化碳水溶液220mL即为反应生成的二氧化碳的体积,由此,生成二氧化碳的质量为:220 mL/1000×1.8 g/L=0.396 g.根据二氧化碳的质量及反应的化学方程式便可求出碳酸钠的质量,就能得出样品中碳酸钠的质量分数.
(6)氢氧化钠部分变质,故既要鉴定含有碳酸钠又要鉴定含有氢氧化钠.
解答:解:(1)氢氧化钠可以和空气中的二氧化碳反应,生成碳酸钠而变质,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
(2)做有气体参与的连续性实验的一般步骤是,连接装置→检验装置气密性→装药品→做实验.
(3)本题的实验目的是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水,所以用饱和的二氧化碳水溶液,可以避免二氧化碳的减少.
(4)证明硫酸过量,即证明碳酸钠反应完,所以可以继续滴一滴硫酸,没有气泡产生.
(5)解:生成二氧化碳的质量为:
×1.8 g/L=0.396 g
设样品中含碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 0.396g
=
解之得:x=0.954g
∴样品中碳酸钠的质量分数=
×100%=47.7%
(6)检验氢氧化钠部分变质,既要鉴定含有碳酸钠又要鉴定含有氢氧化钠,鉴定碳酸钠就是鉴定碳酸根离子,可通过与氯化钙反应生成碳酸钙来鉴定,鉴定氢氧化钠就是鉴定氢氧根离子,可通过其能使无色酚酞试液变红来进行鉴定.
故答案为:(1)2NaOH+CO2═Na2CO3+H2O;
(2)检查装置的气密性;(3)避免二氧化碳溶解在水里而损耗,造成测定结果偏低;(4)滴加稀硫酸无气泡产生
(5)47.7%
(6)叙述检验氢氧化钠部分变质的方法:
(2)做有气体参与的连续性实验的一般步骤是,连接装置→检验装置气密性→装药品→做实验.
(3)本题的实验目的是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水,所以用饱和的二氧化碳水溶液,可以避免二氧化碳的减少.
(4)证明硫酸过量,即证明碳酸钠反应完,所以可以继续滴一滴硫酸,没有气泡产生.
(5)解:生成二氧化碳的质量为:
| 220 |
| 1000 |
设样品中含碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 0.396g
| 106 |
| 44 |
| x |
| 0.396g |
解之得:x=0.954g
∴样品中碳酸钠的质量分数=
| 0.954g |
| 2g |
(6)检验氢氧化钠部分变质,既要鉴定含有碳酸钠又要鉴定含有氢氧化钠,鉴定碳酸钠就是鉴定碳酸根离子,可通过与氯化钙反应生成碳酸钙来鉴定,鉴定氢氧化钠就是鉴定氢氧根离子,可通过其能使无色酚酞试液变红来进行鉴定.
故答案为:(1)2NaOH+CO2═Na2CO3+H2O;
(2)检查装置的气密性;(3)避免二氧化碳溶解在水里而损耗,造成测定结果偏低;(4)滴加稀硫酸无气泡产生
(5)47.7%
(6)叙述检验氢氧化钠部分变质的方法:
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取样,溶于水,滴加 过量的氯化钙溶液 |
有白色沉淀产生 | 氢氧化钠部分变质 |
| 步骤二:静置,向上清液中滴加 酚酞 |
变红 |
点评:本题是一道相当综合的试题,试题以氢氧化钠在空气中变质为切入点,将初中两种重要的物质的化学性质进行了考查,同时涉及了装置的连接、根据化学方程式的计算和实验过程的探究等.本题学生值得研究.

练习册系列答案
相关题目
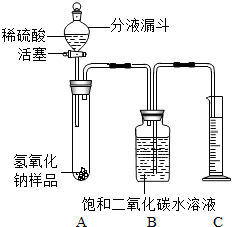 某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在27℃,101kPa下进行,实验步骤如下:
某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在27℃,101kPa下进行,实验步骤如下: