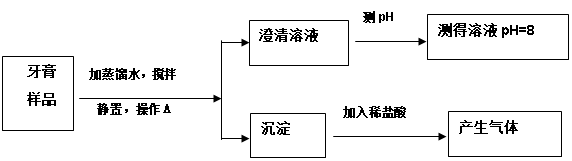
题目内容
小明发现家中施用的碳酸氢铵(NH4HCO3)减少了,并闻到一股刺激性的气味。他很好奇,于是和同学们进行探究,请你一同参与:

[提出问题] 碳酸氢氨减少的原因是什么?
[猜想假设] 碳酸氢铵受热易分解,产物可能为水、二氧化碳、氨气。
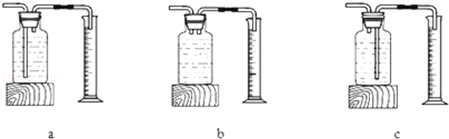
[实验设计] 小明设计了如右图所示的装置进行实验 (实验装置中的铁架台省略)。
⑴A装置大烧杯中的生石灰和水的作用是
。
⑵装置B中澄清石灰水 ,证明产物中有二氧化碳生成。
⑶根据现象 ,证明实验后生成了水和氨气。
⑷小红同学认为若将装置B中澄清石灰水改为NaOH溶液,再经过某实验操作,也可以证明碳酸氢铵分解后有二氧化碳生成,请你帮她设计完成实验:
[实验结论] 碳酸氢铵受热易分解,其反应的化学方程式为 。
[实验反思] 根据以上实验,你认为化肥碳酸氢铵在保存时应注意的问题是
,在施用时注意 。

[提出问题] 碳酸氢氨减少的原因是什么?
[猜想假设] 碳酸氢铵受热易分解,产物可能为水、二氧化碳、氨气。
[实验设计] 小明设计了如右图所示的装置进行实验 (实验装置中的铁架台省略)。
⑴A装置大烧杯中的生石灰和水的作用是
。
⑵装置B中澄清石灰水 ,证明产物中有二氧化碳生成。
⑶根据现象 ,证明实验后生成了水和氨气。
⑷小红同学认为若将装置B中澄清石灰水改为NaOH溶液,再经过某实验操作,也可以证明碳酸氢铵分解后有二氧化碳生成,请你帮她设计完成实验:
| 实验步骤 | 实验现象 | 反应的方程式 |
| | | |
[实验反思] 根据以上实验,你认为化肥碳酸氢铵在保存时应注意的问题是
,在施用时注意 。
⑴生石灰和水反应放出热量,使碳酸氢氨分解 ⑵变浑浊
⑶干燥的红色石蕊试纸变蓝
(合理答案均可得分)
NH4HCO3=NH3↑+H2O+CO2↑
避光、避热、密封 避免在气温较高、日照比较强烈的中午施用
⑶干燥的红色石蕊试纸变蓝
| 取装置B中溶液少许,滴加稀盐酸 (或氯化钙或氢氧化钡溶液) | 产生气泡 | Na2CO3+2HCl=2NaCl+CO2↑+H2O |
NH4HCO3=NH3↑+H2O+CO2↑
避光、避热、密封 避免在气温较高、日照比较强烈的中午施用
试题分析:有题意可知:
[实验设计]
⑴A装置大烧杯中的生石灰和水的作用是利用生石灰和水反应放出热量,使碳酸氢氨分解。
⑵装置B中澄清石灰水变浑浊,证明产物中有二氧化碳生成。
⑶根据现象干燥的红色石蕊试纸变蓝,证明实验后生成了水和氨气。
⑷小红同学认为若将装置B中澄清石灰水改为NaOH溶液,再经过某实验操作,也可以证明碳酸氢铵分解后有二氧化碳生成,设计完成实验如下:
| 实验步骤 | 实验现象 | 反应的方程式 |
| 取装置B中溶液少许,滴加稀盐酸 | 产生气泡 | Na2CO3+2HCl=2NaCl+CO2↑+H2O |
[实验反思] 根据以上实验,你认为化肥碳酸氢铵在保存时应注意的问题是避光、避热、密封,在施用时注意避免在气温较高、日照比较强烈的中午施用。
点评:实验设计和探究题是现在常考的题型,一般难度都挺大的,关键是要求同学们有将已有知识进行归纳和综合运用的能力,同学们在平时的练习中要注意训练自己这方面的能力。

练习册系列答案
相关题目