题目内容
【题目】氢氧化钠是化学实验室中常用的试剂。
(1)氢氧化钠固体曝露在空气中,容易__________,还能_________,所以必须密封保存。
(2)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起,反应的化学方程式为:
SiO2 + 2NaOH == X + H2O,试推断X的化学式为 ____________。
(3)工业上常用电解饱和食盐水的方法制取氢氧化钠。食盐的来源可以先用海水获取粗盐再用粗盐提纯得到精盐,试分析以下过程后填写下列空白:
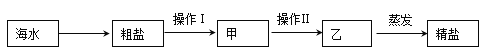
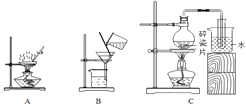
①操作Ⅰ的名称是____________;
②海水晒盐与下述操作中_________的原理相同;
③上述操作可能用到下列装置,其中装置B的作用是___________________ 。
(4)某化学兴趣小组称取8.0gNaOH固体,欲配成20%的溶液,需量取_______ ml蒸馏水。该兴趣小组向配好的溶液中通入一定量的CO2充分反应后,将溶液低温蒸发,获得固体经称量质量为13.7g。
【提出疑问】通过分析,大家认为得到的固体的质量数据可能有问题。按初中化学现有知识计算,8.0gNaOH若全部转化为Na2CO3,固体的质量应该为_____g。
【查阅资料】向Na2CO3溶液中通入CO2会生成NaHCO3。请写出该反应的化学反应方程式:
________。
【讨论计算】上述反应中生成的Na2CO3的质量为__________g; NaHCO3的质量为________g;通入CO2的质量为__________g。
【答案】 吸水潮解 与二氧化碳反应 Na2SiO3 溶解 A 过滤 32.0 10.6 Na2CO3+CO2+H2O═2NaHCO3 5.3 8.4 6.6
【解析】(1)氢氧化钠固体曝露在空气中,容易吸水潮解,能与二氧化碳反应生成碳酸钠而变质,故必须密封保存;(2)根据反应的化学方程式为:SiO2+2NaOH═X+H2O,反应前含有1个Si原子,4个O原子,2个Na原子,2个H原子,反应后含有2个H原子,1个O原子,故X中含有2个Na原子,1个Si原子,3个O原子,故X的化学式为Na2SiO3;(3)①操作Ⅰ是溶解;②海水晒盐与蒸发的原理相同,故填:A;③根据图示可以看出,装置B的作用是过滤;(4)称取8.0gNaOH固体,配成20%的溶液,则溶液的质量为:8.0g÷20%=40g,故水的质量为:40g8.0g=32.0g,故需量取32.0ml蒸馏水;【提出疑问】设生成碳酸钠的质量为x,此时通入二氧化碳的质量为a,则有:
2NaOHCO2Na2CO3
80 44106
8g ax
![]()
![]() =10.6g,a=4.4g,【查阅资料】向Na2CO3溶液中通入CO2则碳酸钠、水和二氧化碳会反应生成NaHCO3,化学方程式为:Na2CO3+H2O+CO2═2NaHCO3;【讨论计算】得到的固体的质量为13.7g,设通入的二氧化碳的质量为y
=10.6g,a=4.4g,【查阅资料】向Na2CO3溶液中通入CO2则碳酸钠、水和二氧化碳会反应生成NaHCO3,化学方程式为:Na2CO3+H2O+CO2═2NaHCO3;【讨论计算】得到的固体的质量为13.7g,设通入的二氧化碳的质量为y
Na2CO3+H2O+CO2═2NaHCO3
106 44 168
![]() y
y ![]()
(10.6g![]() )+
)+![]() =13.7g
=13.7g
y=2.2g,
故Na2CO3的质量为10.6g5.3g=5.3g;NaHCO3的质量为![]() =8.4g;通入CO2的质量为(4.4g+2.2g)=6.6g。
=8.4g;通入CO2的质量为(4.4g+2.2g)=6.6g。