题目内容
【题目】为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小科采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如下表:
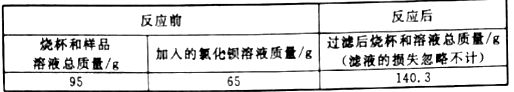
请回答下列问题:
(1)在反应前后的溶液中,下列元素质量保持不变的是 。
A.钠元素 B.碳元素 C.钡元素 D.氧元素
(2)反应共生成沉淀 克
(3)原样品中NaOH的质量分数是多少?
【答案】
(1)A (2)19.7 (3)29.3%
【解析】
(1)在反应后碳元素、氧元素生成碳酸钡沉淀,质量减少,反应前无钡元素,反应后有钡元素,钡元素质量增加,氢氧化钠中钠元素反应前后不变,碳酸钠反应后转化为氯化钠,其钠元素质量也不变,故在反应前后的溶液中,元素质量保持不变的是钠,逸因此选A;
(2)反应共生成沉淀的质量为95g+65g-140.3g=19.7g。
(3)设样品中碳酸钠的质量为x。
Na2CO3 + BaCl2== BaCO3 ↓+2NaCl
106 197
x 19.7g
![]()
x=10.6g
样品中氢氧化钠的质量=15g-10.6g=4.4g。
样品中氢氧化钠的质量分数=![]() =29.3%
=29.3%
答:原样品中NaOH的质量分数是29.3%。

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目