题目内容
【题目】硫酸是一种常见的化学试剂,工业和农业中使用广泛。
(1)硫酸是由________种元素组成,0.1mol硫酸的质量为_____g,约含_________个硫原子。
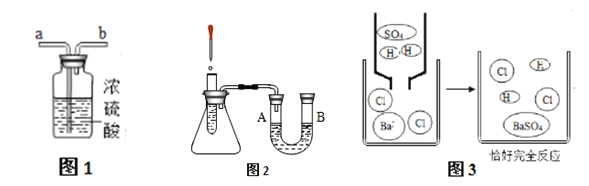
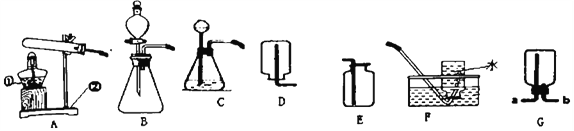
(2)浓硫酸可作干燥剂,若干燥排水法收集的氧气,气体从图1_______端(选“a”或“b”)通入。
(3)图2所示,U型管中是红墨水,向试管中加入浓硫酸,U型管中红墨水液面变化情况是_______。
(4)将氧化铜粉末放入足量稀硫酸中至反应结束,写出发生的化学方程式____________。
(5)将硫酸溶液加入盛有BaCl2溶液的烧杯中,物质变化的微观示意图如图3, 观察到明显的实验现象是 _________。
【答案】 3 9.8 6.02×1022 a A低B高(合理答案皆可) CuO+H2SO4=CuSO4+H2O 产生白色沉淀
【解析】(1)硫酸是由碳,氢,氧三种元素组成,0.1mol硫酸的质量为0.1mol ×98g/mol=9.8g,约含0.1mol×6.02×1023 个/mol=6.02×1022 个硫原子。(2)浓硫酸可作干燥剂,若干燥排水法收集的氧气,气体从图1 a端通入。(3)图2所示,U型管中是红墨水,向试管中加入浓硫酸,浓硫酸溶液水放热,容器内气体膨胀,气压升高,U型管中红墨水液面变化情况是A低B高。(4)将氧化铜粉末放入足量稀硫酸中至反应结束,发生的化学方程式是CuO+H2SO4 =CuSO4+H2O。 (5)将硫酸溶液加入盛有BaCl2溶液的烧杯中反应生成硫酸钡不溶于酸的白色沉淀,观察到明显的实验现象是产生白色沉淀。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目