题目内容
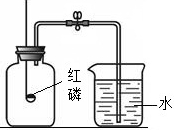 为探究空气中氧气的含量,某同学利用右图进行实验,请你回答有关问题:
为探究空气中氧气的含量,某同学利用右图进行实验,请你回答有关问题:(1)写出红磷燃烧的化学方程式
(2)燃烧匙内放入过量红磷的原因是
(3)已知镁在空气中燃烧可分别与氧气和氮气反应,都生成固体物质,此实验中
镁
分析:(1)红磷燃烧,产生大量的白烟;由反应物、生成物、反应条件可以写出反应的化学方程式;
(2)从实验目的和准确性回答需要注意的事项;
(3)根据镁燃烧消耗氧气和氮气,反应后进入集气瓶中的水量偏多分析.
(2)从实验目的和准确性回答需要注意的事项;
(3)根据镁燃烧消耗氧气和氮气,反应后进入集气瓶中的水量偏多分析.
解答:解:(1)红磷燃烧时有黄白色火焰,冒出大量的白烟,放出热量,反应的化学方程式为:4P+5O2
2P2O5;
(2)为了使集气瓶中的氧气完全消耗掉,燃烧匙内要放过量的红磷;为确保实验结论的准确性,实验中还应注意的问题有:实验装置的气密性要良好;等装置冷却到室温才能打开弹簧夹等;
(3)镁在空气中燃烧可分别与氧气和氮气反应,都生成固体物质,因此集气瓶中气体减少会很多,进入集气瓶中的水就很多,造成测得的氧气的含量偏大,故镁不能代替红磷测量空气中氧气的含量.
故答案为:(1)4P+5O2
2P2O5; 红磷燃烧产生大量白烟.
(2)使集气瓶内氧气完全反应;实验装置的气密性良好或等装置冷却到室温才能打开弹簧夹;
(3)不能,造成测得的氧气含量偏大.
| ||
(2)为了使集气瓶中的氧气完全消耗掉,燃烧匙内要放过量的红磷;为确保实验结论的准确性,实验中还应注意的问题有:实验装置的气密性要良好;等装置冷却到室温才能打开弹簧夹等;
(3)镁在空气中燃烧可分别与氧气和氮气反应,都生成固体物质,因此集气瓶中气体减少会很多,进入集气瓶中的水就很多,造成测得的氧气的含量偏大,故镁不能代替红磷测量空气中氧气的含量.
故答案为:(1)4P+5O2
| ||
(2)使集气瓶内氧气完全反应;实验装置的气密性良好或等装置冷却到室温才能打开弹簧夹;
(3)不能,造成测得的氧气含量偏大.
点评:本题主要考查红磷测定空气组成的实验原理、现象及误差分析,掌握测定的原理是解题的关键.

练习册系列答案
相关题目
| |||||||||||||||||||
 15、某化学课外兴趣小组,开展了以下两项活动:
15、某化学课外兴趣小组,开展了以下两项活动: 实验过程中溶液的pH变化曲线如右图所示:
实验过程中溶液的pH变化曲线如右图所示:
 某化学课外兴趣小组,开展了以下两项活动:
某化学课外兴趣小组,开展了以下两项活动: 实验过程中溶液的pH变化曲线如右图所示:
实验过程中溶液的pH变化曲线如右图所示:
