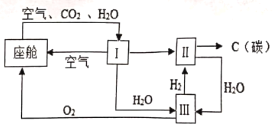
题目内容
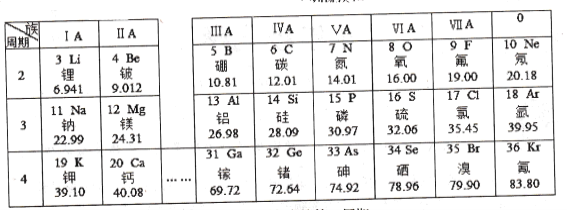
【题目】为庆祝元素周期表诞生150周年,联合国将2019年定为国际化学元素周期表年,请根据下表(元素周期表的部分内容)回答有关问题:
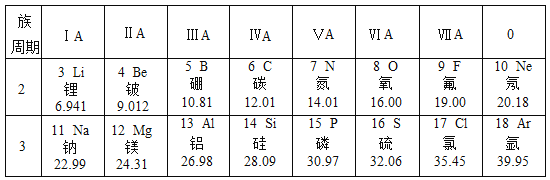
(1)具有相似化学性质的一组元素是_______
a.C和Ne b.Be和Mg c.Al和Si d.F和Cl
(2)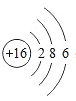 是_______(填元素名称)元素的原子结构示意图。该原子在化学反应中易_______(填“得到”或“失去”)电子,形成的离子的符号为_______。
是_______(填元素名称)元素的原子结构示意图。该原子在化学反应中易_______(填“得到”或“失去”)电子,形成的离子的符号为_______。
(3)由第17号元素和第12号元素的原子形成的化合物的化学式为________。
(4)钠、氯、氧三种元素可形成原子个数比为1:1:4的化合物,则此化合物中氯元素的化合价为________。
(5)具有相同原子数和电子数的分子或离子叫等电子体。下列各组粒子中属于等电子体的_______。
a. NO和O2 b. CO和N2 c. SO2和CO2 d. NH4+和H2O
【答案】b,d 硫 得到 S2- MgCl2 +7价 B
【解析】
(1)具有相似的化学性质需要最外层电子数相同,a,b,c,d四个选项中,只有b和d中元素的最外层电子数相同:b中两原子最外层电子数为2;d中两原子最外层电子数为7。
(2)从图中得知该原子的原子核内有16个质子,故为硫原子;因最外层电子数为6,大于4,故在化学反应中易得到2个电,形成硫离子,硫离子带两个单位负电荷,故符号为“S2-”;
(3)第17号元素为氯,第12号元素为镁,这两种元素在化合物中分别常显-1和+2价,故两元素所形成的的化合物化学式为MgCl2;
(4)钠、氯、氧三种元素可形成原子个数比为1:1:4的化合物,则该物质化学式为NaClO4,根据化合物的化合价代数和为0,可得氯元素化合价=2×4-1=7,故为+7价;
(5)等电子体具有相同原子数和电子数的分子或离子。a中原子数相同,但电子数不同;b中原子数相同,电子数6+8=7+7,为等电子体;c中原子数相同,但电子数16+16≠6+16;d中原子数不相同,电子数相同;故为等电子体的只有b。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的是()
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
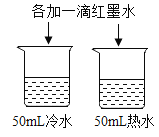
A | 探究温度对分子运动快慢的影响 |
| B | 探究水对铁钉锈蚀的影响 |
|
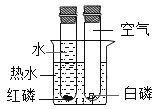
C | 探究空气是燃烧的必要条件 |
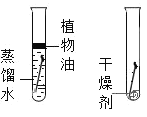
| D | 探究同种物质在不同溶剂中的溶解性 |
|
A.AB.BC.CD.D