题目内容
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图,其中反应Ⅲ制取ClO2的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
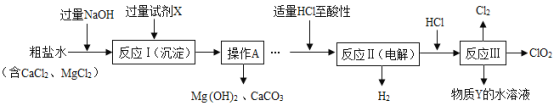
(1)试剂X是_____(填化学式);
(2)操作A的名称是_____;该操作中玻璃棒的作用_____;
(3)加入适量HCl除为了满足电解时的微酸性外,还能除去溶液中的杂质离子,请写出其中所发生的中和反应的化学方程式:_____;
(4)为提高经济效益,生产过程中除将H2和Cl2制成HCl充分利用外,还可循环使用的物质是_____。
【答案】Na2CO3 过滤 引流 NaOH+HCl=NaCl+H2O 水和氯化钠
【解析】
(1)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,所以试剂X是Na2CO3;
(2)过滤可以将不溶性固体从溶液中分离出来,所以操作A的名称是过滤,该操作中玻璃棒的作用引流;
(3)氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(4)由于开始氯化钠和水都是反应物,而后期是生成物,所以该流程中可以循环利用的物质是水和氯化钠。

【题目】实验室有一部分被氧化成氧化镁的镁粉样品、未知浓度盐酸和40%的氢氧化钠溶液。兴趣小组同学为分析样品中金属镁的质量百分含量和计算盐酸的质量分株,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量。实验数据如下表所示:
实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
Ⅰ | 16.0 | 60.0 | 0.5 |
Ⅱ | 16.0 | 130.0 | 1.0 |
Ⅲ | 16.0 | 150.0 | 1.0 |
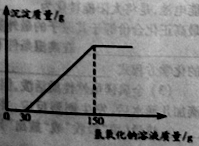
镁粉样品中金属镁的质量百分含量为_________________。
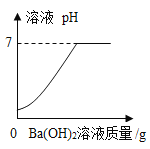
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)