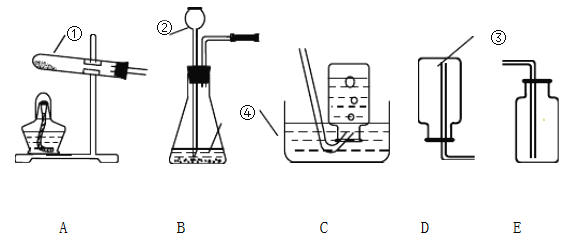
��Ŀ����
����Ŀ����ѧС������ʦ��ָ���£���ʵ�����ð���(NH3)��������̼�ͱ����Ȼ�����Һ��ԭ���� ȡС�մ�(NaHCO3)����ȡ��������ͼ��ʾ��
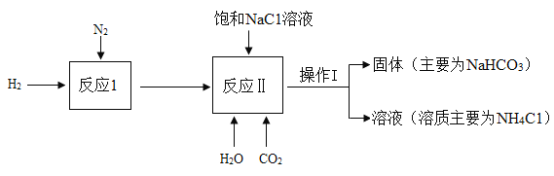
(1)����Ӧ I�����ڸ��¡���ѹ���������ڵ������·�����һ�ֻ��Ϸ�Ӧ��Ŀ������ȡ ����Ӧ II������İ������仯ѧ����ʽΪ_________��
(2)������ I������IJ���������_________��
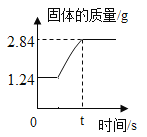
(3)����Ӧ II����������ͬ��NaHCO3 ������һ������ͬ�����»�ȡ NaHCO3 �IJ������� ���±���ʾ��
��� | ��Ӧ�¶�/�� | ��Ӧʱ��/min | NaHCO3����/% |
a | 30 | 60 | 86.8 |
b | 30 | 120 | X |
c | 35 | 60 | 89.4 |
d | 35 | 120 | 92.5 |
e | 40 | 60 | 85.3 |
f | 40 | 120 | 85.6 |
��X ����ֵ������_________�����ţ���
A 85.8 B 86.8 C 92.1 D 93.1
�ڲ�������֪������Ӧ II����������������Ӧ�� NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3 ��+NH4Cl,��������ͬ��Ӧʱ�䣬40��ʱ̼�����ƵIJ��ʱ� 35��ʱ�͵Ŀ���ԭ��___________
(4)����Ʒ NH4Cl ���������� NH3��һ�������£�����þ�� NH4Cl ��Ӧ�ɻ�ȡ�߲��ʵ�NH3 ���������ֻ���������ֻ�����Ļ�ѧʽ�ֱ�Ϊ_________��_________��
���𰸡�N2+3H2 2NH3 �ձ�����������©����ֻ��һ�ֻ����ֲ����֣� C �¶Ƚϸ�ʱ��NH4HCO3 �����ֽ⣬����̼�����Ƶķ�Ӧ�з�Ӧ��������� MgCl2 H2O
2NH3 �ձ�����������©����ֻ��һ�ֻ����ֲ����֣� C �¶Ƚϸ�ʱ��NH4HCO3 �����ֽ⣬����̼�����Ƶķ�Ӧ�з�Ӧ��������� MgCl2 H2O
��������
��1������Ӧ I�����ڸ��¡���ѹ���������ڵ������·�����һ�ֻ��Ϸ�Ӧ��Ŀ������ȡ ����Ӧ II������İ������÷�Ӧ�����õ����������ڸ��¡���ѹ���������ڵ������·�Ӧ���ɰ������仯ѧ����ʽΪ��N2+3H2 2NH3��
2NH3��
��2�������� I���ܽ�������Һ����룬��������IJ��������ձ�����������©����
��3���ٷ�����ͬ�����»�ȡ NaHCO3�IJ������ݿ�֪��X ����ֵ������92.1%����ѡC��
�ڲ�������֪������Ӧ II����������������Ӧ�� NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3 ��+NH4Cl,��������ͬ��Ӧʱ�䣬40��ʱ̼�����ƵIJ��ʱ� 35��ʱ�͵Ŀ���ԭ���¶Ƚϸ�ʱ��NH4HCO3 �����ֽ⣬����̼�����Ƶķ�Ӧ�з�Ӧ��������٣�
��4������Ʒ NH4Cl ���������� NH3��һ�������£�����þ��NH4Cl��Ӧ�ɻ�ȡ�߲��ʵ�NH3 ���������ֻ�������������غ㶨�ɿ�֪�������ֻ�����Ļ�ѧʽ�ֱ�ΪMgCl2��H2O��

 53������ϵ�д�
53������ϵ�д�