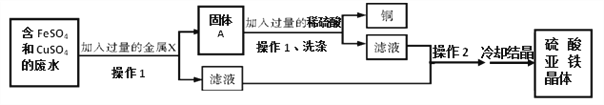
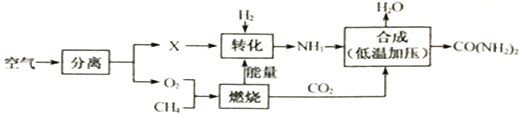
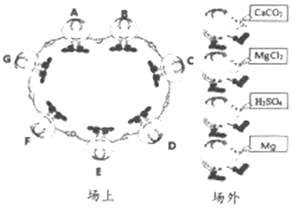
题目内容
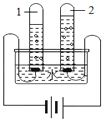
【题目】将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。下列说法不正确的是

A. 反应前后阴、阳离子的总数目不变
B. 反应前后溶液的总质量不变
C. 反应后溶液呈中性
D. 反应前后元素种类不变
【答案】A
【解析】
A. 由反应的微观示意图可知,反应前有4个阳离子、4个阴离子,而反应后有2个阳离子、2个阴离子,反应后阴、阳离子的的总数减少,此选项错误;
B. 此反应过程中无气体和沉淀生成,根据质量守恒定律,反应前后溶液的总重量质量不变,此选项正确;
C. 根据反应的微观示意图可知,反应前后溶液中含有氯化钠和水两种物质,氯化钠溶液呈中性,所以反应后的溶液呈中性,此选项正确;
D. 化学反应前后元素种类不变,此选项正确。故选A。

 文敬图书课时先锋系列答案
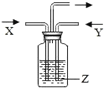
文敬图书课时先锋系列答案【题目】如图,将气体 X 和气体 Y 同时通入液体 Z 中,最终一定能看到液体变浑浊的是( )
X | Y | Z | 装置 | |
A | H2 | N2 | 水 |
|
B | HCl | CO2 | 澄清石灰水 | |
C | O2 | HCl | 硝酸银溶液 | |
D | O2 | CO2 | 烧碱溶液 |
A. AB. BC. CD. D
【题目】某校化学兴趣小组对苏打(Na2CO3)和小苏打(NaHCO3)在生活中具有何作用、如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答相关问题。
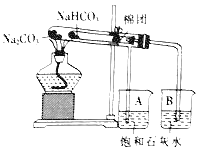
(查阅资料)
信息①相同条件下,碳酸钠溶液的碱性比碳酸氢钠溶的强;
信息②:NaHCO3在270℃时完全分解,会产生一种白色固体以及二氧化碳和水,而Na2CO3不易分解。
(实验过程)
(1)实验一:充分加热后,A、B两个烧杯中分别看到的现象是_____、_____,由此可得出的结论是_____。
(2)实验二:充分利用信息知识,区分无色Na2CO3溶液与NaHCO 3液最简单的方法是_____(填字母)。
A 加热 B 用pH试纸测碱性强弱 C 滴加稀盐酸
(实验反思)
(3)该装置设计的优点是_____。
(4)实验中应注意的问题是_____。
(5)可用小苏打治疗轻度胃酸(主要含盐酸)过多的病人,其原因是_____(用化学方程式进行说明)。
(注意:若答对(实验拓展)奖励4分,化学试卷总分不超过60分。)
(实验拓展)该兴趣小组的同学认为充分加热 NaHCO 3后的白色固体产物可能是NaOH或Na2CO3.请设计实验检验反应后的固体产物,并完成如表。限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管。
序号 | 实验操作 | 预期现象 | 结论 |
I | 取少量加热后的固体产物于试管A中,加入适量的蒸馏水,充分振荡、溶解,再加入足量的_____,振荡、静置 | 产生白色沉淀 | 产物含Na2CO3 |
Ⅱ | 少量操作后的上层清液于试管B中,滴加_____ | _____ | 产物不含NaOH |