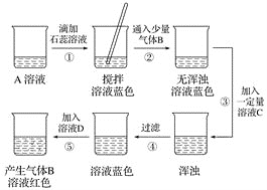
题目内容
【题目】海水中含有丰富的自然资源,一般是先将海水淡化获得淡水,再通过一系列工艺流程从剩余的浓海水中提取其他产品,从浓海水制取镁的主要反应过程如下图所示。

请回答下列问题
(1)用浓海水可以制得粗盐,方法是_________________。
(2)电解熔融氯化镁的化学方程式为______________________________。
(3)溶解1.16吨氢氧化镁至少需要质量分数为10%的稀盐酸______吨?请写出计算过程。
【答案】 蒸发溶剂 MgCl2 ![]() Mg+Cl2↑ 14.6t
Mg+Cl2↑ 14.6t
【解析】(1)氯化钠溶解度受温度影响变化不大,用浓海水可以制得粗盐,方法是蒸发溶剂。(2)电解熔融氯化镁的化学方程式为MgCl2 ![]() Mg+Cl2↑。
Mg+Cl2↑。
(3)解∶设溶解1.16吨氢氧化镁至少需要质量分数为10%的稀盐酸质量为x
Mg﹙OH﹚2 +2HCl=MgCl2 +2H2O
58 73
1.16t 10%×x
![]() =
= ![]() , x=14.6t.
, x=14.6t.
点睛∶物质溶解度受温度影响变化不大溶液提取晶体时使用蒸发溶剂的方法。正确书写化学方程式,并根据化学方程式进行简单的计算是顺利完成本题的重要保证。

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
【题目】实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数 | 累计加入氯化钙溶液的质量/g | 烧杯中溶液的总质量/g |
一 | 40 | 134 |
二 | 80 | 168 |
三 | 120 | 202 |
四 | 150 | 232 |
(1)恰好完全反应时,生成沉淀的总质量为____g。
(2)第四次测量时,所得溶液中的溶质有_______(填化学式)。
(3)计算氯化钙溶液的溶质质量分数为______________(写出计算过程)。