题目内容
【题目】同学们在实验室完成实验探究后得到废液 A,其中含有稀硫酸、硫酸亚铁和硫酸铜。老师将同学们分成甲乙两组,继续进行如下实验,请完成相关问题:
(甲组任务)将废液转化成硫酸亚铁晶体。实验流程如图1:
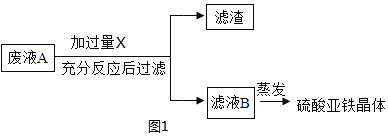
①实验流程中X 是_____(写物质名称),过量的目的是_____,反应现象是_____,写出一个涉及的化学方程式是_____,该反应的基本类型_____。
(乙组任务)利用废液来探究金属铝的化学性质。实验流程如图2:
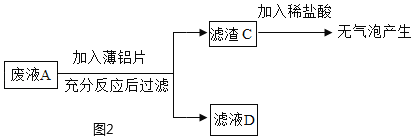
②滤渣 C 中一定没有_____。
③滤液 D 中一定含有的溶质是_____(填化学式,下同),可能含有的溶质是_____。
【答案】铁 将稀硫酸、硫酸铜完全转化为硫酸亚铁 有气泡冒出,固体逐渐转化为红色 Fe+H2SO4=FeSO4+H2↑或Fe+CuSO4=FeSO4+Cu 置换反应 铁和铝 FeSO4和Al2(SO4)3 CuSO4和H2SO4
【解析】
①废液 A中含有稀硫酸、硫酸亚铁和硫酸铜,需要将废液转化成硫酸亚铁晶体,所以实验流程中X 是铁,铁与硫酸反应生成硫酸亚铁和氢气,铁与硫酸铜反应生成硫酸亚铁和铜,过量的目的是将稀硫酸、硫酸铜完全转化为硫酸亚铁,现象为有气泡冒出,固体逐渐转化为红色,化学方程式为Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=FeSO4+Cu,该反应符合“单质+化合物=新单质+新化合物”属于置换反应;
②滤渣C中加入稀硫酸没有气泡产生,所以滤渣C中一定没有铁和铝;
③铝与硫酸铜反应生成硫酸铝和铜,滤渣C中加入稀硫酸没有气泡产生,所以硫酸亚铁没有与铝反应,由于滤液D中一定含有的溶质是:硫酸铝和硫酸亚铁,可能含有的溶质是:CuSO4和H2SO4;因为铝太少;

 阅读快车系列答案
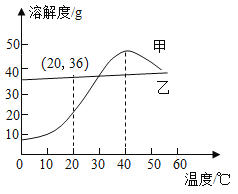
阅读快车系列答案【题目】室温时几种物质的溶解度如表所示。室温下向 396g 硝酸钾饱和溶液中投入 20g 食盐,下列推断正确的是( )
物质 | S(g/100g 水) |
氯化钠 | 36 |
硝酸钾 | 32 |
硝酸钠 | 86 |
氯化钾 | 37 |
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,溶液中有少量晶体析出
D.食盐溶解,硝酸钾变为不饱和溶液