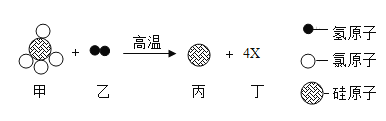
题目内容
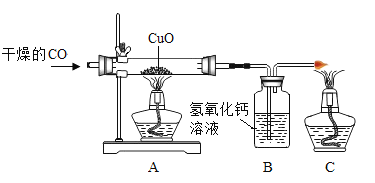
【题目】某化学兴趣小组用如图装置验证一氧化碳还原氧化铜。
[资料卡片]
Ⅰ.一氧化碳还原氧化铜,除生成铜外还可能生成氧化亚铜(Cu2O),Cu2O为不溶于水的红色固体。
Ⅱ.铜不与稀硫酸反应:Cu2O溶于H2SO4的化学方程式: ![]()
[合作探究]
(1) A装置中发生反应的现象是_____。
(2)完全反应后固体成分的探究
[提出问题]完全反应后固体的成分是什么?
[猜想假设]猜想①只含Cu 猜想②只含Cu2O 猜想③Cu2O和Cu.
[实验验证]该小组为验证上述猜想,取少量反应后的固体于试管中,加入足量的稀硫酸,观察到溶液变为蓝色,试管底部仍有少量固体。
根据上述实验现象,可知原固体中一定含有_____。
[数据处理]为进一步确定反应后固体的成分,某同学另取一定质量的该固体,与足量稀硫酸充分反应,经过滤、洗涤、干燥后称量剩余固体,有关数据如下表,请填写表中内容。
反应后固体 | 剩余固体 | 反应后固体中单质铜的质量分数 | 实验结论 |
7.96g | 4.76g | _____, | 猜想_____成立 |
【答案】黑色粉末变成红色 Cu2O 27.6% ③
【解析】
(1)A装置中发生的反应是一氧化碳还原氧化铜,氧化亚铜和铜都是红色,则反应的现象是黑色粉末变成红色;
(2)
[实验验证]
根据“取少量反应后的固体于试管中,加入足量的稀硫酸,观察到溶液变为蓝色”说明原固体中一定含有氧化亚铜,不能确定原固体中是否含有铜,因为![]() 中有铜生成;
中有铜生成;
[数据处理]
设反应后固体中氧化亚铜的质量为x,反应后固体中单质铜的质量为7.96g-x,
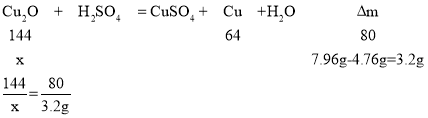
解得x=5.76g<7.96g,则反应后固体中单质铜的质量为7.96g-5.76g,即反应后固体中单质铜的质量分数=![]() ;
;
由上分析可知原固体中一定含有氧化亚铜和铜,猜想③成立。

【题目】为测定久置于空气中的氢氧化钠样品的变质程度,某化学活动小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配成50g溶液,再向锥形瓶中滴加稀硫酸,反应过程中产生气体质量的部分实验数据和锥形瓶中溶液质量变化的图象如图表所示:
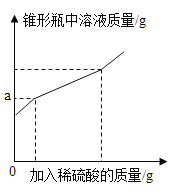
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
(1)6.5g样品与稀硫酸完全反应产生气体的质量是__________g。
(2)6.5g样品中碳酸钠的质量分数是___________。(结果精确至0.1%)