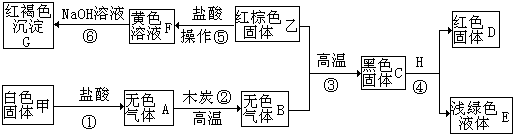
题目内容
酚酞是化学实验室常用的酸碱指示剂,化学式是C20H14O4,请计算:
(1)酚酞中碳、氢、氧原子的个数比为 ;
(2)酚酞中碳元素和氧元素的质量比为 (最简整数比);
(3)酚酞中氧元素的质量分数为 (小数点后保留一位小数).
(1)酚酞中碳、氢、氧原子的个数比为
(2)酚酞中碳元素和氧元素的质量比为
(3)酚酞中氧元素的质量分数为
考点:元素质量比的计算,元素的质量分数计算
专题:化学式的计算
分析:(1)根据标在元素符号右下角的数字表示一个分子中所含原子的个数;进行解答;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答.
(3)化合物中元素的质量分数=
×100%,据此进行分析解答.
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答.
(3)化合物中元素的质量分数=
| 相对原子质量×原子个数 |
| 相对分子质量 |
解答:解:(1)根据标在元素符号右下角的数字表示一个分子中所含原子的个数;可得酚酞C20H14O4分子中C、H、O元素的原子个数比为 20:14:4=10:7:2;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得酚酞中碳、氧元素的质量比为(12×20):16×4=15:4;
(3)酚酞中氧元素的质量分数为
×100%≈20.1%.
故答案为:
(1)10:7:2;
(2)15:4;
(3)20.1%.
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得酚酞中碳、氧元素的质量比为(12×20):16×4=15:4;
(3)酚酞中氧元素的质量分数为
| 16×4 |
| 12×20+1×14+16×4 |
故答案为:
(1)10:7:2;
(2)15:4;
(3)20.1%.
点评:本题考查学生对物质化学式含义的理解、化合物中元素质量比计算方法的掌握与应用的能力.

练习册系列答案
相关题目
 某同学称取一定质量的铁粉样品(含有少量不与稀硫酸反应,也不溶于水的固体杂质)于烧杯中,加入9.8%的稀硫酸100g,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
某同学称取一定质量的铁粉样品(含有少量不与稀硫酸反应,也不溶于水的固体杂质)于烧杯中,加入9.8%的稀硫酸100g,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题: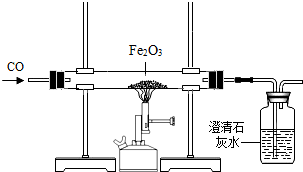 如图所示,用已经验纯的CO进行实验,
如图所示,用已经验纯的CO进行实验,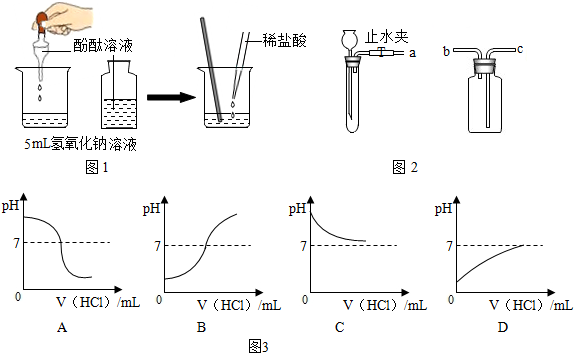
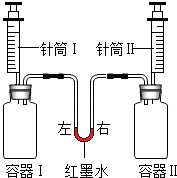 如图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示.
如图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示.