题目内容
盐酸是实验室常用的重要试剂,请回答下列问题: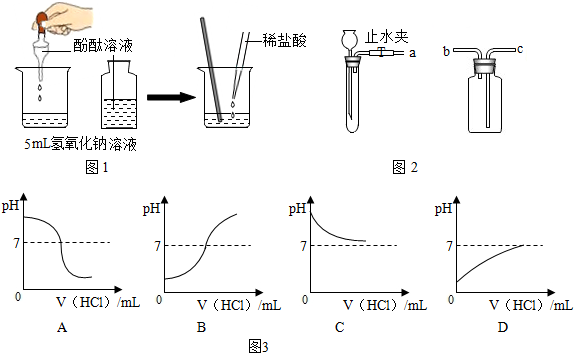
(1)为探究盐酸与氢氧化钠溶液的反应,设计下列实验方案(如图1):向5mL稀氢氧化钠溶液中滴加3滴酚酞溶液,然后逐滴加入稀盐酸,并用玻璃棒不断搅拌.
①实验过程中观察到的现象是 .
②向稀氢氧化钠溶液滴加稀盐酸至过量,溶液pH变化的曲线正确的是(如图3) (填写字母标号).
(2)实验室可以利用稀盐酸等药品,通过连接图2装置制取二氧化碳、氢气.
①制取二氧化碳气体装置的连接顺序是 (填写字母,下同),制取氢气装置的连接顺序是 .
②块状固体加入试管中的方法是 .
③检查发生装置气密性的方法是 .

(1)为探究盐酸与氢氧化钠溶液的反应,设计下列实验方案(如图1):向5mL稀氢氧化钠溶液中滴加3滴酚酞溶液,然后逐滴加入稀盐酸,并用玻璃棒不断搅拌.
①实验过程中观察到的现象是
②向稀氢氧化钠溶液滴加稀盐酸至过量,溶液pH变化的曲线正确的是(如图3)
(2)实验室可以利用稀盐酸等药品,通过连接图2装置制取二氧化碳、氢气.
①制取二氧化碳气体装置的连接顺序是
②块状固体加入试管中的方法是
③检查发生装置气密性的方法是
考点:中和反应及其应用,检查装置的气密性,生石灰的性质与用途,溶液的酸碱性与pH值的关系
专题:常见的酸 酸的通性
分析:(1)①酚酞试液遇碱性溶液变红,遇酸性溶液和中性溶液不变色,氢氧化钠能与盐酸反应生成氯化钠和水.
②该反应是酸碱中和反应,一开始是碱过量,随着反应的进行,溶液显中性;当反应结束后,继续滴加稀盐酸,即酸过量,溶液显酸性;
(2)①根据二氧化碳、氢气的密度分析用收集气体的进气端;②根据取用块状固体的方法分析;③根据装置气密性检验的方法分析.
②该反应是酸碱中和反应,一开始是碱过量,随着反应的进行,溶液显中性;当反应结束后,继续滴加稀盐酸,即酸过量,溶液显酸性;
(2)①根据二氧化碳、氢气的密度分析用收集气体的进气端;②根据取用块状固体的方法分析;③根据装置气密性检验的方法分析.
解答:解:(1)①氢氧化钠溶液呈碱性,能使酚酞试液变红,加入盐酸,使用玻璃棒搅拌,盐酸能与氢氧化钠反应生成氯化钠和水,氯化钠的水溶液呈中性,不能使酚酞试液变色,继续加入盐酸,溶液呈酸性,酚酞不变色;
②氢氧化钠的溶液显碱性,pH值>7;随着稀盐酸的加入,溶液的pH逐渐减小,反应结束时,pH值=7;稀盐酸继续滴加,溶液显酸性,溶液的pH值<7;
(2)①由于二氧化碳的密度比空气大,因此进气管是长管,而氢气的密度比空气小,因此进气管是短管.
故答案为:a→c;a→b;
②向试管中加入块状固体药品时,为了防止打破试管底,要把试管横放,然后用镊子取用块状固体放在试管口,再慢慢竖起试管,让固体缓缓滑到试管底部;
③将橡胶管用止水夹夹住,然后通过长颈漏斗向试管内注水形成液面差,静置一段时间,若液面差不发生变化,说明装置的气密性良好.若继续下降,则说明此装置气密性不好.
故答案是:(1)①溶液先变红色,加入稀盐酸后溶液红色逐渐褪去;
②A;
(2)①a→c;a→b;
②先将试管横放,用镊子夹取块状固体放在试管口,再慢慢竖立试管,使块状固体缓缓滑到试管底部;
③将橡胶管用止水夹夹住,然后通过长颈漏斗向试管内注水形成液面差,静置一段时间,若液面差不发生变化,说明装置的气密性良好.
②氢氧化钠的溶液显碱性,pH值>7;随着稀盐酸的加入,溶液的pH逐渐减小,反应结束时,pH值=7;稀盐酸继续滴加,溶液显酸性,溶液的pH值<7;
(2)①由于二氧化碳的密度比空气大,因此进气管是长管,而氢气的密度比空气小,因此进气管是短管.
故答案为:a→c;a→b;
②向试管中加入块状固体药品时,为了防止打破试管底,要把试管横放,然后用镊子取用块状固体放在试管口,再慢慢竖起试管,让固体缓缓滑到试管底部;
③将橡胶管用止水夹夹住,然后通过长颈漏斗向试管内注水形成液面差,静置一段时间,若液面差不发生变化,说明装置的气密性良好.若继续下降,则说明此装置气密性不好.
故答案是:(1)①溶液先变红色,加入稀盐酸后溶液红色逐渐褪去;
②A;
(2)①a→c;a→b;
②先将试管横放,用镊子夹取块状固体放在试管口,再慢慢竖立试管,使块状固体缓缓滑到试管底部;
③将橡胶管用止水夹夹住,然后通过长颈漏斗向试管内注水形成液面差,静置一段时间,若液面差不发生变化,说明装置的气密性良好.
点评:本题以图象的形式考查了酸碱中和反应时溶液PH的变化,以及物质间的质量关系、气体的收集、气密性的检查,知识点较多,解答中和反应的问题时要掌握溶液的酸碱性和溶液PH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
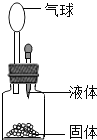 要使如图装置中的小气球鼓起来,则使用的固体和液体可以是
要使如图装置中的小气球鼓起来,则使用的固体和液体可以是①生石灰和水;②石灰石和稀盐酸;③氢氧化钠固体和水;④硝酸铵和水( )
| A、①②③④ | B、①②③ |
| C、①②④ | D、②③④ |
