题目内容
将氯酸钾和二氧化锰的混合物27.5克放入大试管中加热,充分反应后,冷却称量,试管内剩余物质的质量为17.9克,则在反应过程中产生氧气多少克?剩余物质是什么?各多少克.
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据质量守恒定律,混合物减少的质量就是生成的氧气的质量.
(2)根据氯酸钾和二氧化锰制取氧气的反应的方程式,由氧气的质量可求出氯化钾的质量,由此求出二氧化锰的质量.
(2)根据氯酸钾和二氧化锰制取氧气的反应的方程式,由氧气的质量可求出氯化钾的质量,由此求出二氧化锰的质量.
解答:解:(1)由题意可知,生成氧气的质量即反应前后固体物质的质量差为:27.5g-17.9g=9.6g
(2)设10.7g固体物质中氯化钾的质量为x
2KClO3
2KCl+3O2↑
149 96
x 9.6g
=
x=14.9g
由于是充分反应,所以没有剩余的氯酸钾,所以17.9g固体物质中二氧化锰的质量为:17.9g-14.9g=3g
答:(1)产生氧气的质量为9.6g,(2)17.9g固体物质中氯化钾的质量为14.9g,二氧化锰3g.
(2)设10.7g固体物质中氯化钾的质量为x
2KClO3
| ||
| △ |
149 96
x 9.6g
| 149 |
| x |
| 96 |
| 9.6g |
x=14.9g
由于是充分反应,所以没有剩余的氯酸钾,所以17.9g固体物质中二氧化锰的质量为:17.9g-14.9g=3g
答:(1)产生氧气的质量为9.6g,(2)17.9g固体物质中氯化钾的质量为14.9g,二氧化锰3g.
点评:解答本题的关键是要分析出试管内质量的减少量就是生成的氧气质量,再根据氧气质量结合化学方程式进一步计算.

练习册系列答案
相关题目
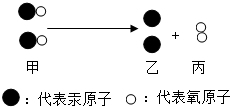 氧化汞受热会发生分解,该反应的微观示意图如图:下列说法不正确的是( )
氧化汞受热会发生分解,该反应的微观示意图如图:下列说法不正确的是( )| A、该反应的基本反应类型为置换反应 |
| B、甲物质是一种氧化物 |
| C、该反应前后原子的种类不变 |
| D、乙、丙两种物质都属于单质 |

 所示,该元素的原子核外电子层有几个?它属于金属元素还是非金属元素?其在化学反应中易得得到还是失去电子?
所示,该元素的原子核外电子层有几个?它属于金属元素还是非金属元素?其在化学反应中易得得到还是失去电子? 所示的粒子符号,并指出该元素位于哪一周期哪一族.
所示的粒子符号,并指出该元素位于哪一周期哪一族.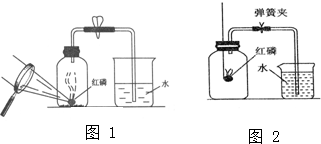
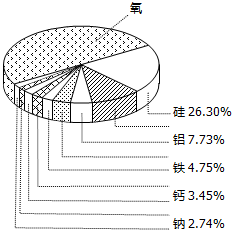 如图表示的是地壳里所含各种元素的质量分数.请根据图回答下列问题:
如图表示的是地壳里所含各种元素的质量分数.请根据图回答下列问题: