题目内容
 (2013?历城区二模)小丽同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究.
(2013?历城区二模)小丽同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究.[提出问题]这瓶NaOH溶液变质程度如何呢?
[提出猜想]小丽的猜想:NaOH溶液部分变质.你的新猜想:
NaOH溶液完全变质
NaOH溶液完全变质
.[实验探究]小丽设计如下实验来验证自己的猜想,请根据表中内容填写小丽实验时的现象:
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液 | NaOH溶液部分变质 |
溶液为无色
溶液为无色
.[实验反思]下列物质①Ca(OH)2溶液、②Ba(NO3)2溶液、③BaCl2溶液,能替代小丽实验中CaCl2溶液的是
②③
②③
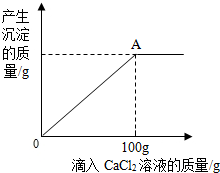
(填序号).[拓展应用]通过实际实验,确认这瓶放置已久的NaOH溶液部分变质.现取100g待测溶液,向其中逐滴加入11.1%的CaCl2溶液.产生沉淀质量与所加CaCl2溶液质量的关系如图所示.
(1)A点处所得溶液中溶质有
NaCl、NaOH
NaCl、NaOH
.(2)求待测溶液中Na2CO3的质量分数.( 写出计算过程)
分析:氢氧化钠在空气中会与空气中的二氧化碳反应生成碳酸钠,检验氢氧化钠是否全部变质也就是看碳酸钠中还有没有剩余的氢氧化钠,主要根据检验碳酸根离子和氢氧根离子的方法来确定;
检验碳酸根离子但不会除去氢氧根离子应用钙离子或钡离子,但不可混入氢氧根离子,以免对氢氧化钠的检验造成影响;
当滴加氯化钙溶液到A点时,碳酸钠恰好反应完,有生成的氯化钠,可能还有未变质的氢氧化钠;
欲求待测溶液中碳酸钠的质量分数,必须要知道碳酸钠的质量和待测溶液的质量,待测溶液的质量已知,碳酸钠的质量可根据氯化钙的质量求出.
检验碳酸根离子但不会除去氢氧根离子应用钙离子或钡离子,但不可混入氢氧根离子,以免对氢氧化钠的检验造成影响;
当滴加氯化钙溶液到A点时,碳酸钠恰好反应完,有生成的氯化钠,可能还有未变质的氢氧化钠;
欲求待测溶液中碳酸钠的质量分数,必须要知道碳酸钠的质量和待测溶液的质量,待测溶液的质量已知,碳酸钠的质量可根据氯化钙的质量求出.
解答:解:【提出猜想】NaOH溶液全部变质
【实验探究】氢氧化钠在空气中会与空气中的二氧化碳反应生成碳酸钠,检验氢氧化钠部分变质,也就是既有碳酸钠还有氢氧化钠,因此加入氯化钙会和碳酸钠反应产生碳酸钙沉淀,过量的氯化钙还能把碳酸钠的碱性消除,再加入酚酞试液,剩余的氢氧化钠会使酚酞试液变成红色.故答案为:产生白色沉淀,溶液变红;
若全部变质,变质后的溶液中因不含氢氧化钠而不出现溶液变红,只会观察到有沉淀.故答案为:产生白色沉淀,溶液不变红;
【实验反思】(1)为了不影响氢氧化钠的检验,所加入的试剂不能为碱性溶液或不能反应后生成碱性物质,而氢氧化钙呈碱性且能与碳酸钠反应后都生成氢氧化钠,因此,不能使用①Ca(OH)2溶液代替氯化钙溶液,故选②③;
【拓展应用】
(1)当氯化钙溶液滴加到A点时,碳酸钠恰好反应完,有生成的氯化钠,原溶液中还有未变质的氢氧化钠.故答案为:NaOH、NaCl;
(2)解:设Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111
x 100g×11.1%
=11.1g
=
x=10.6g
所以碳酸钠的质量分数=
×100%=10.6%
答:待测溶液中碳酸钠的质量分数为10.6%.
故答案为:NaOH溶液完全变质; 产生白色沉淀,溶液显红色;溶液为无色; ②③;
(1)NaCl、NaOH;
(2)解:设Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111
x 100g×11.1%
=11.1g
=
x=10.6g
所以碳酸钠的质量分数=
×100%=10.6%
答:待测溶液中碳酸钠的质量分数为10.6%.
【实验探究】氢氧化钠在空气中会与空气中的二氧化碳反应生成碳酸钠,检验氢氧化钠部分变质,也就是既有碳酸钠还有氢氧化钠,因此加入氯化钙会和碳酸钠反应产生碳酸钙沉淀,过量的氯化钙还能把碳酸钠的碱性消除,再加入酚酞试液,剩余的氢氧化钠会使酚酞试液变成红色.故答案为:产生白色沉淀,溶液变红;
若全部变质,变质后的溶液中因不含氢氧化钠而不出现溶液变红,只会观察到有沉淀.故答案为:产生白色沉淀,溶液不变红;
【实验反思】(1)为了不影响氢氧化钠的检验,所加入的试剂不能为碱性溶液或不能反应后生成碱性物质,而氢氧化钙呈碱性且能与碳酸钠反应后都生成氢氧化钠,因此,不能使用①Ca(OH)2溶液代替氯化钙溶液,故选②③;
【拓展应用】
(1)当氯化钙溶液滴加到A点时,碳酸钠恰好反应完,有生成的氯化钠,原溶液中还有未变质的氢氧化钠.故答案为:NaOH、NaCl;
(2)解:设Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111
x 100g×11.1%
=11.1g
| 106 |
| x |
| 111 |
| 11.1g |
x=10.6g
所以碳酸钠的质量分数=
| 10.6g |
| 100g |
答:待测溶液中碳酸钠的质量分数为10.6%.
故答案为:NaOH溶液完全变质; 产生白色沉淀,溶液显红色;溶液为无色; ②③;
(1)NaCl、NaOH;
(2)解:设Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111
x 100g×11.1%
=11.1g
| 106 |
| x |
| 111 |
| 11.1g |
x=10.6g
所以碳酸钠的质量分数=
| 10.6g |
| 100g |
答:待测溶液中碳酸钠的质量分数为10.6%.
点评:本题考查了氢氧化钠变质程度的考查,注意:为防止干扰氢氧化钠的检验,检验碳酸根离子的物质不能用碱性物质或反应后生成碱性物质的物质,为考查的易错点.

练习册系列答案
相关题目