题目内容
36、某化学兴趣小组的同学在实验室配制质量分数为12%的氢氧化钠溶液,并来分析氢氧化钠溶液的变质情况.
(1)配制150g质量分数为12%的氢氧化钠溶液.
①计算:需要氢氧化钠固体的质量为
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的
A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码.
该步骤中用烧杯而不用纸称量氢氧化钠的原因是
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温.
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签.
(2)①写出氢氧化钠溶液在空气中变质的化学方程式
②能否用酚酞试液检验氢氧化钠溶液是否变质?如不能请说明理由
③请你用一种简单可行的化学方法来证明氢氧化钠溶液已变质
④氢氧化钠可以用纯碱溶液与消石灰反应制备得到,请写出化学方程式
(1)配制150g质量分数为12%的氢氧化钠溶液.
①计算:需要氢氧化钠固体的质量为
18
g,水的体积为全132
mL(水的密度近似看作lg/cm3).②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的
左
盘,称量其质量.然后BA
(按操作的先后顺序选填字母),直至天平平衡.A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码.
该步骤中用烧杯而不用纸称量氢氧化钠的原因是
氢氧化钠易潮解(或氢氧化钠具有腐蚀性)
.③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温.
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签.
(2)①写出氢氧化钠溶液在空气中变质的化学方程式
CO2+2NaOH=Na2CO3+H2O
.②能否用酚酞试液检验氢氧化钠溶液是否变质?如不能请说明理由
不能说明,因为碳酸钠和氢氧化钠溶液都能使酚酞试液变红
.③请你用一种简单可行的化学方法来证明氢氧化钠溶液已变质
取少量样品于试管中,加入适量稀盐酸,有气泡产生,证明氢氧化钠变质
(用文字说明).④氢氧化钠可以用纯碱溶液与消石灰反应制备得到,请写出化学方程式
Na2CO3+Ca(OH)2═2NaOH+CaCO3↓
.分析:(1)①利用溶质质量=溶液质量×溶质质量分数计算配制溶液时所需氢氧化钠的质量,利用溶剂质量=溶液质量-溶质质量计算配制所需水的质量,再使用m=ρV换算出水的体积;
②使用天平称量一定量的固体药品时,需要再调节天平平衡后,放入砝码、移动游码至所需称量的质量,然后向左盘的烧杯内加入氢氧化钠至天平平衡;由于氢氧化钠易吸收空气中水而潮解且具有很强的腐蚀性,在称量氢氧化钠时需要放在玻璃容器内进行,防止氢氧化钠腐蚀天平托盘;
(2)①氢氧化钠变质的原因:二氧化碳与氢氧化钠反应;
②碳酸钠溶液和氢氧化钠溶液都呈碱性,都能使酚酞试液变红色;
③判断某一氢氧化钠样品是否变质的方法是:取少量样品于试管中,加入适量稀盐酸,看是否有气体生成;
④纯碱溶液与消石灰反应生成碳酸钙和氢氧化钠.
②使用天平称量一定量的固体药品时,需要再调节天平平衡后,放入砝码、移动游码至所需称量的质量,然后向左盘的烧杯内加入氢氧化钠至天平平衡;由于氢氧化钠易吸收空气中水而潮解且具有很强的腐蚀性,在称量氢氧化钠时需要放在玻璃容器内进行,防止氢氧化钠腐蚀天平托盘;
(2)①氢氧化钠变质的原因:二氧化碳与氢氧化钠反应;
②碳酸钠溶液和氢氧化钠溶液都呈碱性,都能使酚酞试液变红色;
③判断某一氢氧化钠样品是否变质的方法是:取少量样品于试管中,加入适量稀盐酸,看是否有气体生成;
④纯碱溶液与消石灰反应生成碳酸钙和氢氧化钠.
解答:解:(1)①150g质量分数为12%的氢氧化钠溶液中氢氧化钠的质量=150g×12%=18g,则配制需要水的质量=150g-18g=132g,(合132mL);
②根据“左物右码”的原则,称量时药品需放在天平左盘;称量一定量药品时,应先加入砝码、移动游码至所需要称量的质量然后加入药品至平衡;由于氢氧化钠具有很强的腐蚀性,为防止氢氧化钠腐蚀天平的托盘,应把氢氧化钠放入玻璃容器内进行称量;
(2)①氢氧化钠溶液变质的原因:与空气中的反应;二氧化碳与氢氧化钠反应的方程式为:CO2+2NaOH=Na2CO3+H2O.
②碳酸钠溶液和氢氧化钠溶液都呈碱性,都能使酚酞试液变红色,不能用酚酞试液检验氢氧化钠溶液是否变质;
③判断氢氧化钠样品是否变质的方法是:取少量样品于试管中,加入适量稀盐酸,有气泡产生,证明氢氧化钠变质;
④纯碱溶液与消石灰反应生成碳酸钙和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓.
故答案为:(1)①18,132;②左,BA,氢氧化钠易潮解(或氢氧化钠具有腐蚀性);
(2)①CO2+2NaOH=Na2CO3+H2O;
②不能说明,因为碳酸钠和氢氧化钠溶液都能使酚酞试液变红;
③取少量样品于试管中,加入适量稀盐酸,有气泡产生,证明氢氧化钠变质;
④Na2CO3+Ca(OH)2═2NaOH+CaCO3↓.
②根据“左物右码”的原则,称量时药品需放在天平左盘;称量一定量药品时,应先加入砝码、移动游码至所需要称量的质量然后加入药品至平衡;由于氢氧化钠具有很强的腐蚀性,为防止氢氧化钠腐蚀天平的托盘,应把氢氧化钠放入玻璃容器内进行称量;
(2)①氢氧化钠溶液变质的原因:与空气中的反应;二氧化碳与氢氧化钠反应的方程式为:CO2+2NaOH=Na2CO3+H2O.
②碳酸钠溶液和氢氧化钠溶液都呈碱性,都能使酚酞试液变红色,不能用酚酞试液检验氢氧化钠溶液是否变质;
③判断氢氧化钠样品是否变质的方法是:取少量样品于试管中,加入适量稀盐酸,有气泡产生,证明氢氧化钠变质;
④纯碱溶液与消石灰反应生成碳酸钙和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓.
故答案为:(1)①18,132;②左,BA,氢氧化钠易潮解(或氢氧化钠具有腐蚀性);
(2)①CO2+2NaOH=Na2CO3+H2O;
②不能说明,因为碳酸钠和氢氧化钠溶液都能使酚酞试液变红;
③取少量样品于试管中,加入适量稀盐酸,有气泡产生,证明氢氧化钠变质;
④Na2CO3+Ca(OH)2═2NaOH+CaCO3↓.
点评:本题考查了一定溶质质量分数溶液的配制和探究氢氧化钠溶液是否变质,要掌握一定溶质质量分数溶液的配制的步骤和注意事项,氢氧化钠和碳酸钠的性质.

练习册系列答案
相关题目
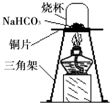 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.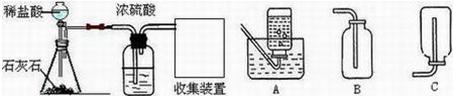
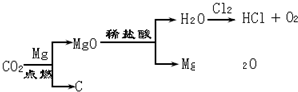
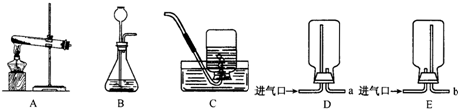
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.