题目内容
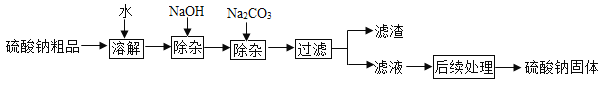
【题目】硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸钠粗品中含有少量CaC12和MgC12实验室进行提纯的流程如下:
回答下列问题:
(1)用NaOH和Na2CO3除杂时,反应的化学方程式分别为:______、____。
(2) NaOH和Na2CO3如果添加过量了,可加入适量____溶液除去。请任写出一个相关反应方程式:____。
(3)由滤液经后续处理→硫酸钠固体,用到的实验操作是____。
【答案】![]()
![]() 稀硫酸
稀硫酸 ![]() 蒸发结晶、过滤
蒸发结晶、过滤
【解析】
氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,硫酸和氢氧化钠反应生成硫酸钠和水,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳。
(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为![]() ;
; ![]() 。
。
(2)硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质,故除去过量的氢氧化钠和碳酸钠时,可以用稀硫酸;稀硫酸与氢氧化钠反应生成硫酸钠和水,反应的化学方程式为![]() 。
。
(3)被加热的滤液中含有一定量的NaCl,单纯的蒸发操作无法得到纯净的硫酸钠晶体,应该加热使大部分硫酸钠晶体析出,而此时溶液中主要为氯化钠,然后过滤除去滤液,从而得较纯净的硫酸钠晶体,由滤液经后续处理→硫酸钠固体,用到的实验操作是蒸发结晶、过滤。

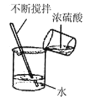
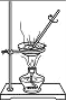
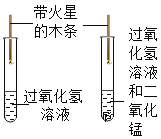
【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的是( )
编号 | ① | ② | ③ | ④ |
实验设计 |
|
|
|
|
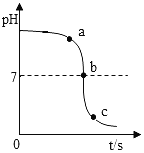
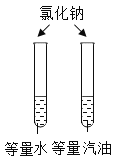
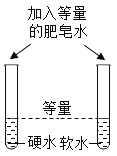
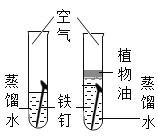
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 区分硬水和软水 | 探究铁生锈的条件 | 研究二氧化锰的催化作用 |
A.①B.②C.③D.④
【题目】化学学科实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成,让同学们设计实验进行探究。
(提出问题)固体样品的成分是什么?
(查阅资料)(1)碱石灰干燥剂是CaO和NaOH的混合物。
(2)BaCl2溶液显中性。
(猜想与假设)固体样品中可能含有 Fe、Fe2O3、CaO、NaOH、Ca(OH)2、Na2CO3和_____等七种物质。
(进行实验)
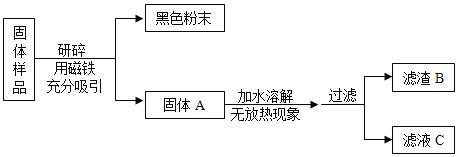
甲组同学对滤渣B的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 | ①_____________________ ②____________________ | 结论:滤渣B中的Fe2O3,CaCO3。盐酸和Fe2O3反应的化学方程式为:_________ |
乙组同学对滤液C的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论 |
取少量滤液C于试管中,加入过量BaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 | 有白色沉淀生成 酚酞试液由无色变成红色 | 滤液C中有___________ |
(1)乙组同学实验中加入过量BaCl2 溶液的目的是_____。
(2)通过以上实验探究,该固体样品中能确定一定含有的成分是_____。