��Ŀ����
����Ŀ��ijͬѧ����������Ʒ���ж�����̼����ʵ�顣

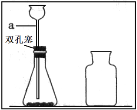
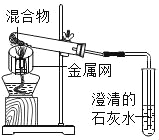
��ʵ��1����ͼ1����CO2��������ƿ�У�Ѹ�ٵ����ƿ����ˮ������ƿ�ǡ�������۲쵽����ƿ���ԭ����________��
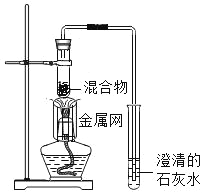
��ʵ��2����ͼ2��ΰ�٢��������ڸ��μ�2����ɫʯ����Һ������ٿ��еμ�5��ʵ��1����ƿ�е�Һ�壬��ڿ��еμ�5������ˮ���۲쵽�ٿ�����ɫʯ���죬����ԭ����_____(�û�ѧ����ʽ��ʾ)���ڿ��еμӵ�������ˮ��Ŀ����______��
��ʵ��3��
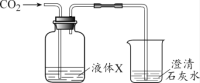
(1)��XΪ����ʯ��ˮ���۲쵽��������____������ʯ��ˮ�з�����Ӧ�Ļ�ѧ����ʽΪ____��
(2)��XΪ����������Һ���۲쵽����ʯ��ˮ��������������ԭ�������_____��
���𰸡�������̼����ˮ����ˮ��Ӧ������������٣�ƿ��ѹǿ��С H2O+CO2�TH2CO3 �������� ����ʯ��ˮ����� CO2+Ca��OH��2=CaCO3��+H2O CO2��NaOH��ȫ��Ӧ
��������
[ʵ��1]��ͼ1����CO2��������ƿ�У�Ѹ�ٵ����ƿ����ˮ������ƿ�ǣ�������۲쵽����ƿ���ԭ���ǣ�������̼����ˮ����ˮ��Ӧ������������٣�ƿ��ѹǿ��С��
[ʵ��2]��ͼ2��ΰ�٢��������ڸ��μ�2����ɫʯ����Һ������ٿ��еμ�5��ʵ��1����ƿ�е�Һ�壬��ڿ��еμ�5������ˮ���۲쵽�ٿ�����ɫʯ���죬����ԭ���Ƕ�����̼����ˮ����������̼�ᣬ��Ӧ�Ļ�ѧ����ʽ�ǣ�H2O+CO2�TH2CO3���ڿ��еμӵ�������ˮ��Ŀ���Ƕ������ã�
[ʵ��3]��1�������������Ʒ�Ӧ������̼��Ƴ�����ˮ��������XΪ����ʯ��ˮ���۲쵽�������dz���ʯ��ˮ����ǣ�����ʯ��ˮ�з�����Ӧ�Ļ�ѧ����ʽΪ��CO2+Ca��OH��2=CaCO3��+H2O��
��2�����ڶ�����̼�����������Ʒ�Ӧ������̼���ƺ�ˮ����XΪ����������Һ���۲쵽����ʯ��ˮ��������������ԭ���ǣ�CO2��NaOH��ȫ��Ӧ��

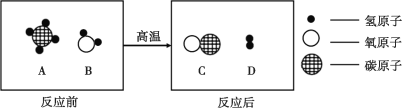
����Ŀ��̼��ԭ����ͭ��ʵ������ͼ��ʾ��д���÷�Ӧ�Ļ�ѧ����ʽ____��
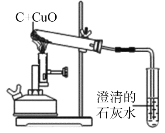
��������⣩̼ȼ��ʱ��������CO2Ҳ��������CO����ô̼������ͭ��Ӧ���ɵ������Ƿ�Ҳ�ж��ֿ��ܣ�
���������룩����٣�CO
����ڣ�CO2
��ۣ�____________��
����Ʒ�����ʵ��װ����ͼ��Ũ���������ˮ���ã�����K������ͨ�����ĵ���һ��ʱ�䣬�ر�K����ȼ�ƾ���ƺ;ƾ��ƣ���ַ�Ӧ��Ϩ��ƾ���ƺ;ƾ��ƣ���K����ͨһ��ʱ�䵪����
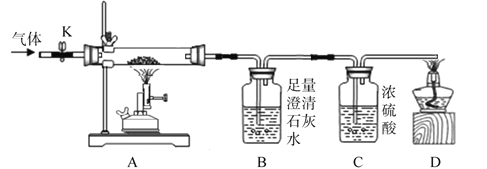
����һ���Ӷ��Թ۲�Ƕ��ж�
��1��ʵ��ʱA����������____________��
��2��������ٳ�����B��D����������_____________������ţ���
a��B�б���ǣ�D���ܵ�ȼ������������������b��B�б���ǣ�D�����ܵ�ȼ
c��B��������ʵ������D���ܵ�ȼ������ d��B��������ʵ������D�����ܵ�ȼ
���������Ӷ�������Ƕ��ж�
ȡһ����̿�ۺ�4g����ͭ�Ļ�������ʵ�飬���ⶨ�����е��ĸ����ݣ�
��Ӧǰ������ | ��Ӧ������� | |
A��������+���壩 | m1 | m2 |
B+C�����ƿ+���Һ�� | m3 | m4 |
��3��������ڳ������������ϣ�m4-m3��__��m1-m2����ѡ���������������=������
��4��������۳�����CuOȫ��ת����Cu����μӷ�Ӧ��̼������m��ȡֵ��Χ��____��
��������˼��ʵ�鿪ʼǰ����ͨ�뵪����Ŀ����____��
����Ŀ��Ϊ̽��̼��ԭ����ͭ�����ʵ����������ľ̿�ۺ�����ͭ�ĸ�������1��2.5g����ϵ��ʵ�顣
���������ϣ�̼��ԭ����ͭ�õ���ͭ�п��ܺ���������ɫ��������ͭ������ͭԪ�صĻ��ϼ�Ϊ+1�ۣ���
������ʵ�飩ʵ��1��ȡ������Ϊ1��11��ľ̿�ۺ�����ͭ�����1.3g������ʵ�顣
��� | 1��1 | 1��2 |
װ�� |
|
|
��Ӧ�����ʵ���ɫ��״̬ | ��ɫ��ĩ�л���������ɫ���� | ��ɫ�����н��������м�������ɫ���� |
ʵ��2��ȡһ�����Ļ�����1��2װ�ý���ʵ�顣
��� | ľ̿��������ͭ�������� | ��Ӧ�����ʵ���ɫ��״̬ | |
2��1 | 1��9 | ��ɫ�����н������� | ����������ɫ���� |
2��2 | 1��10 | ���к�������ɫ���� | |
2��3 | 1��11 | ���м�������ɫ���� | |
2��4 | 1��12 | ��ɫ���� | |
2��5 | 1��13 | ���н϶��ɫ���� | |
��1��������ͭ�Ļ�ѧʽΪ_____��
��2��ʵ��1��2�У�֤�������˶�����̼��������_____����صĻ�ѧ��Ӧ����ʽΪ_____��
��3��ʵ��1��2�У�����Ӧ�������Ƚ������ܴ�ʯ��ˮ��ȡ����Ȼ��ر�ֹˮ�У��ò�����Ȼ��ȴ�������ر�ֹˮ�У����ܳ��ֵ�������_____��
��4��ʵ��1��Ŀ����_____��
��5��ʵ��2�Ľ�����_____��
����˼�����ۣ�
��1����ͬѧ�����ó�ϸ̿��������ͭ��ĩ����ʵ�顣����Ϊ���������������_____��
��2��ʵ��2δ����������Ϊ1��14��ʵ�飬������_____��