题目内容
【题目】化石燃料的燃烧、硫酸的生产都产生二氧化硫,被雨水吸收后会形成酸雨,使农作物、建筑物等遭到破坏。工业烟气通常含有二氧化硫,在排放前需经脱硫处理.如图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略).请回答下列问题: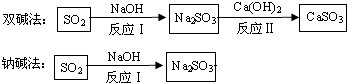
(1)CaSO3中Ca、S、O元素的质量比是 .
(2)已知原料NaOH的价格为5.8元/kg、Ca(OH)2的价格为0.74元/kg.两种工艺中,处理相同质量的SO2 , 所需的原料成本更低(填“双碱法”或“钠碱法”)。
(3)环保部门能较为精确测定某硫酸厂周围空气中二氧化硫的含量。取空气样品1000m3缓缓通过足量氯水(化学方程式:SO2+Cl2+2H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生的白色沉淀质量为2.33g。试回答:
①通过测定雨水的来粗略判断其是否为酸雨。
②配制氯化钡溶液时,需用到的主要玻璃仪器有烧杯、量筒和。
③我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示,请通过计算说明此空气中二氧化硫的浓度级别。
浓度限值(mg/m3) | ||
一级标准 | 二级标准 | 三级标准 |
0.15 | 0.50 | 0.70 |
【答案】
(1)5:4:6
(2)双碱法
(3)PH,玻璃棒,滴管,解:设反应生成的H2SO4质量为x ,1000 m3空气样品中的SO2质量为y
H2SO4+BaCl2= | BaSO4↓ +2HCl | SO2+Cl2+2H2O=2HCl+ | H2SO4 |
98 | 233 | 64 | 98 |
x | 2.33g | y | 0.98g |
98/233=x /2.33g x=0.98g 64/98=y/0.98g y=0.64g0.64g/1000 m3=0.64Mg/ m3 因为 0.50<0.64<0.70,所以为三级标准。
【解析】
(1)CaSO3中Ca、S、O元素的质量比40:32:48=5:4:6;
(2)两种工艺中,处理相同量的SO2,双碱法所需的原料成本更低,原因是通过反应II实现了NaOH的循环利用,减少了NaOH的用量,所以成本降低。故填:双碱法;
(3)①酸雨一般是指pH小于5.6的雨水,所以可以通过测量雨水的pH可对是否是酸雨进行判断;②配置溶液所需的玻璃仪器主要有烧杯、量筒和玻璃棒,滴管;③设溶液中H2SO4的质量为x
H2SO4+BaCl2= | BaSO4↓+2HCl |
98 | 233 |
x | 2.33g |
![]() x=0.98g
x=0.98g
设1000m3空气样品中SO2的质量为y
SO2+Cl2+2H2O=2HCl+ | H2SO4 |
64 | 98 |
y | 0.98g |
![]() y=0.64g
y=0.64g
SO2的浓度:
![]() =0.64mg/m3>0.50mg/m3,为三级标准.
=0.64mg/m3>0.50mg/m3,为三级标准.
答:此空气中二氧化硫的浓度级别为三级标准.
所以答案是:
(1)5:4:6;
(2)双碱法;
(3)①pH;
②玻璃棒.
③
设溶液中H2SO4的质量为x
H2SO4+BaCl2= | BaSO4↓+2HCl |
98 | 233 |
x | 2.33g |
![]() x=0.98g
x=0.98g
设1000m3空气样品中SO2的质量为y
SO2+Cl2+2H2O=2HCl+ | H2SO4 |
64 | 98 |
y | 0.98g |
![]() y=0.64g
y=0.64g
SO2的浓度:
![]() =0.64mg/m3>0.50mg/m3,为三级标准.
=0.64mg/m3>0.50mg/m3,为三级标准.
答:此空气中二氧化硫的浓度级别为三级标准.
【考点精析】通过灵活运用根据化学反应方程式的计算,掌握各物质间质量比=系数×相对分子质量之比即可以解答此题.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
