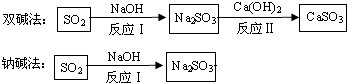
题目内容
【题目】水是人类生活中不可缺少的物质.
下列净水方法中,通常用于除去水中难溶性杂质的是 ,净水程度最高的是
A.过滤 B.煮沸 C.蒸馏 D.吸附
自来水厂常用二氧化氯消毒,其中氯元素的化合价为 ;
自来水中含有少量Ca2等可溶性化合物,烧水时Ca2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一.请写出Ca2受热分解的化学方程式: .
【答案】A; C; +4; Ca2![]() H2O+CaCO3↓+CO2↑;
H2O+CaCO3↓+CO2↑;
【解析】
试题分析:净化水的方法有:沉淀、过滤、吸附和蒸馏。其中过滤主要是除去水中的难溶性杂质,吸附主要是利用活性炭吸附元素和异味,只有通过蒸馏得到的水才是纯净的水。故净水程度最高的是蒸馏;
根据“在化合物中,正负化合价的代数和为零”的原则,已知 O的化合价为-2价,设氯元素的化合价为x,则x+(-2)×2=0,解得x=+4;
根据描述可知该反应的反应物是Ca2,生成物是碳酸钙、水和二氧化碳,反应条件是加热,故反应的化学方程式表示为:Ca2![]() H2O+CaCO3↓+CO2↑。
H2O+CaCO3↓+CO2↑。

练习册系列答案
相关题目
【题目】下列物质的性质和用途,对应关系不正确的是( )
A | B | C | D | |
物质 | 苛性钠 | 干冰 | 小苏打 | 盐酸 |
性质 | 吸水潮解 | 升华吸热 | 能与酸反应 | 能与活泼金属反应 |
用途 | 作某些气体干燥剂 | 人工降雨 | 治疗胃酸过多 | 除铁锈 |
A.AB.BC.CD.D