题目内容
【题目】化学实验是科学探究的重要途径。
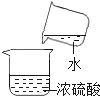
(1)在实验室,浓硫酸要密封保存的原因是________________。(填字母代号)
a 防潮解 b 防挥发 c 防吸水 d 防氧化
(2)探究小组的同学设计如图所示的微型实验装置来探究二氧化碳的制法和性质,打开弹簧夹,并推压加液器的活塞加入盐酸。
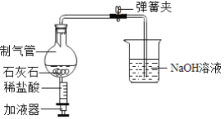
①制气管中发生反应的化学方程式为________________________。
②反应一段时间后,请设计实验证明烧杯中有哪些溶质。(写出实验步骤、现象及结论)____________。
③当制气管中盐酸消耗完,反应停止后,可观察到什么现象?____________。
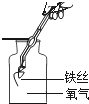
(3)探究小组的同学利用下图装置验证某混合气体中是否含有CO2和CO。

①A、B装置中应分别盛放什么试剂?____________
②若原混合气体中含有CO,可观察到什么实验现象?____________
③写出D中可能发生反应的化学方程式。____________
(4)取10g氯化钠溶液于烧杯中,加入足量的硝酸银溶液,充分应用后过滤,洗涤烘干后得到2.87g固体。请计算该氯化钠溶液中溶质的质量。____________
【答案】C ![]() 取样加入过量的氯化钡溶液,若有白色沉淀生成则存在碳酸钠,静置后,取上层清液,滴入酚酞试液,若溶液变红,则存在氢氧化钠,若溶液呈无色,则溶液中不存在氢氧化钠。 烧杯中的溶液被倒吸进制气管中 澄清的石灰水 氢氧化钠溶液 C中黑色粉末变红,D中澄清石灰水变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O 1.17g
取样加入过量的氯化钡溶液,若有白色沉淀生成则存在碳酸钠,静置后,取上层清液,滴入酚酞试液,若溶液变红,则存在氢氧化钠,若溶液呈无色,则溶液中不存在氢氧化钠。 烧杯中的溶液被倒吸进制气管中 澄清的石灰水 氢氧化钠溶液 C中黑色粉末变红,D中澄清石灰水变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O 1.17g
【解析】
(1)浓硫酸具有吸水性,能吸收空气中的水蒸气。在实验室,浓硫酸要密封保存的原因是防吸水,故选C;
(2)①石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:![]() ;
;
②制气管中产生二氧化碳,进入烧杯中与氢氧化钠反应生成碳酸钠和水,烧杯中一定存在碳酸钠,可能存在氢氧化钠;碳酸钠与氯化钡反应生成碳酸钡的白色沉淀,可用氯化钡溶液检验碳酸钠的存在,碳酸钠与氢氧化钠都呈碱性,碳酸钠对氢氧化钠的检验存在干扰,所以在检验时先用过量的氯化钡溶液检验并完全除去碳酸钠,再用酚酞试液检验是否存在氢氧化钠。实验证明烧杯中溶质的方法是:取样加入过量的氯化钡溶液,若有白色沉淀生成则存在碳酸钠,静置后,取上层清液,滴入酚酞试液,若溶液变红,则存在氢氧化钠,若溶液呈无色,则溶液中不存在氢氧化钠。
③当制气管中盐酸消耗完,反应停止后,二氧化碳被消耗,烧瓶内的气压降低,可观察到烧杯中的溶液被倒吸进制气管中;
(3)①A装置中的试剂需要检验二氧化碳的存在,所以应该放入澄清的石灰水;B装置的试剂除去多余的二氧化碳,防止对一氧化碳产物的干扰,因此可以是氢氧化钠溶液;
②一氧化碳可以还原氧化铜,生成红色的铜,并且生成二氧化碳气体,所以证明原混合气体中CO存在的实验现象是:C中黑色粉末变红,D中澄清石灰水变浑浊;
③二氧化碳和氢氧化钙反应产生碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(4) 设:生成2.87g氯化银沉淀消耗的氯化钠的质量为x。

![]() x=1.17g。
x=1.17g。
答:该氯化钠溶液中溶质的质量1.17g。

 阅读快车系列答案
阅读快车系列答案