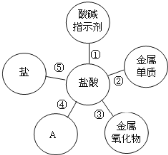
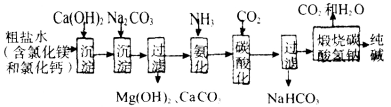题目内容
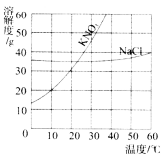
【题目】(5分)下图是氯化钾和硝酸钾两种固体溶解度曲线图。
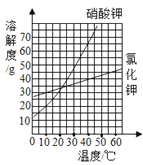
(1)15℃时,KNO3的溶解度是 (填“大于”、“小于”或“等于”)KCl的溶解度。
(2)40℃时,KCl的溶解度是 g,向100g水中加入40gKCl,所得溶液中溶质与溶液的质量比为 。
(3)比较这两种物质溶解度曲线的变化规律,从中你可以获得哪些信息: (任写一条)。
(4)下列说法正确的是 。
A.KNO3饱和溶液一定比不饱和溶液浓
B.饱和KCl溶液析出晶体后,溶液中溶质的质量分数一定不变
C.30℃时,分别将10g KCl和10g KNO3配制成饱和溶液,前者需要水的质量较多
D.分别将40℃时的KCl和KNO3的饱和溶液降温到20℃时,后者析出的晶体较多。
【答案】(1)小于 (2)40 2︰7
(3)硝酸钾的溶解度受温度的影响大,氯化钾物质受温度影响较小 (4)C
【解析】
试题分析:(1)根据溶解度曲线,15℃时,KNO3的溶解度是小于KCl的溶解度
(2)根据溶解度曲线, 40℃时,KCl的溶解度是40g,向100g水中加入40gKCl,所得溶液中溶质与溶液的质量比=40g:(40g+100g)=2︰7
(3)比较这两种物质溶解度曲线的变化规律,可以获得哪些信息: 硝酸钾的溶解度受温度的影响大,氯化钾物质受温度影响较小
(4)A、同一温度下KNO3饱和溶液一定比不饱和溶液浓,而这么没有说明是否为同一温度,错误,B、饱和KCl溶液可以通过降低温度析出晶体,此时溶液中溶质的质量分数变小,错误,C、根据溶解度曲线,30℃时,KCl的溶解度比 KNO3的溶解度要更小,故分别将10g KCl和10g KNO3配制成饱和溶液,前者需要水的质量较多,正确,D、根据溶解度曲线,KCl的溶解度随温度变化的趋势比 KNO3的溶解度要更小,故分别将40℃时等质量的KCl和KNO3的饱和溶液降温到20℃时,后者析出的晶体较多,但这么没有注明是等质量,错误,故选C

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案