题目内容
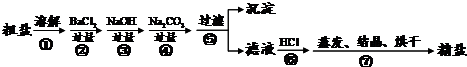
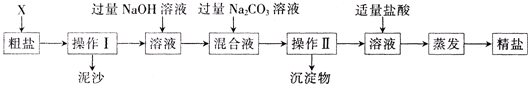
通过海水晾晒可得粗盐.粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质.为了有效将粗盐提纯,实验的各步操作流程如图1所示.

根据以上信息回答:
(1)操作Ⅰ和操作Ⅱ的名称是 .该操作中需要将圆形滤纸折叠处理,下列图2所示中不该出现的情形是 (填序号).
(2)蒸发容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取 等措施.
(3)在实验过程中加入过量的NaOH溶液的目的是 .
(4)判断加入的盐酸“适量”的方法是 .
(5)实验所得氯化钠固体的质量大于粗盐中NaCl的质量,原因是 .
(6)若用所得氯化钠配制50g质量分数为6%的氯化钠溶液,除了用到天平、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是 ,其作用是 .
| (1)分离固体与溶液的方法是过滤;根据图示中的滤纸的折叠处理进行分析; (2)根据 蒸发皿的受热均匀情况进行分析; (3)氢氧化钠可以将水中的镁离子转化为沉淀而得到净水的目的,可以据此解答; (4)盐酸与碳酸钠反应是有气泡产生,可以据此解答; (5)在提纯过程中生成了氯化钠可以据此解答. (6)根据溶液的配制方法进行解答. | |
| 解答: | 解:(1)分离固体与溶液的方法是过滤,I、II都是分理处沉淀的过程.A、B、C 是滤纸的正确的折叠方法,D中的滤纸,接口处出现缝隙,液体会直接的进入下面的烧杯,故不该出现. (2)为了使液体受热均匀而防止液滴的飞溅,所以既可以搅拌,也可以通过移动酒精灯或是移动蒸发皿来使溶液受热更均匀. (3)加入过量的氢氧化钠,氢氧根离子可以和镁离子转化为氢氧化镁沉淀而将镁离子除去. (4)此步是除掉多余的碳酸钠,而盐酸与碳酸钠反应是有气泡产生,从现象即可判断. (5 )在粗盐提纯的过程中,在提纯过程中生成了氯化钠.所以实验所得精盐的质量大于粗盐中NaCl的质量. (6)配制溶液在溶解的时候要用到玻璃棒来搅拌,以加速氯化钠的溶解. 故答案为:(1)过滤;D; (2)间歇加热(或来回移动酒精灯); (3)除尽溶液中的镁离子; (4)滴加盐酸至无气泡放出为止; (5)提纯的过程中有氯化钠生成; (6)玻璃棒;搅拌,加速溶解. |



 某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验: