题目内容
某化学兴趣小组的同学想要绘制硝酸钾、食盐、氢氧化钙的溶解度曲线.用实验方法测定得到这三种物质在不同温度下在水中的溶解度数值,并记录如下:硝酸钾、氯化钠、氢氧化钙在不同温度时的溶解度
| 温度(℃) | 10 | 20 | 30 | 40 | 50 | |
| 硝酸钾(克) | 13.3 | 31.6 | 37.7 | 48.8 | 63.9 | 92.5 |
| 氯化钠(克) | 35.7 | 35.8 | 36.0 | 36.3 | 36.5 | 36.8 |
| 氢氧化钙(克) | 0.19 | 0.18 | 0.17 | 0.16 | 0.14 | 0.12 |
(2)从表格或图象上分析:分离氯化钠和硝酸钾应采用的方法是 ;用此方法时,配制氯化钠和硝酸钾混合溶液的最佳温度为 ;分离时的最佳温度为 (从表格中选择数据填写).在降温过程中,大量析出的物质是 ,为了提高晶体的纯度,应将过滤出的晶体用 (选填“热”或“冷”)水进一步洗涤干净.
(3)要把氢氧化钙的不饱和溶液转变成饱和溶液,可采取的方法有 、 和 .
【答案】分析:根据提供的数据即可找出固体的溶解度和温度间的关系;①比较不同的固体物质在同一温度下的溶解度大小;②查出某固体物质在某温度下的溶解度;③判断出固体物质的溶解度随温度变化的变化情况,从而确定从饱和溶液中使溶质析出的方法,及判断通过降温还是蒸发溶剂的方法达到提纯物质的目的.
解答:解:(1)由于固体的溶解度只受一个外界因素---温度的影响,因此氯化钠和硝酸钾的溶解度和温度间的关系如图所示(温度为横坐标,物质的溶解度为纵坐标)
(2)根据三种物质的溶解度曲线可知,由于硝酸钾的溶解度随温度的升高而明显增大,氯化钠的溶解度受温度的影响不大,氢氧化钙的溶解度随温度的升高而减小,故分离氯化钠和硝酸钾应采用的方法是冷却热饱和溶液法;配制氯化钠和硝酸钾混合溶液的最佳温度为50℃;分离时的最佳温度为20℃;在降温过程中,大量析出的物质是硝酸钾晶体,为了提高晶体的纯度,应将过滤出的晶体用冷水清洗.
(3)氢氧化钙的溶解度随温度的升高而减小,要把氢氧化钙的不饱和溶液转变成饱和溶液,可采取的方法有增加溶质量、蒸发溶剂和升高温度.
故答案为:(1)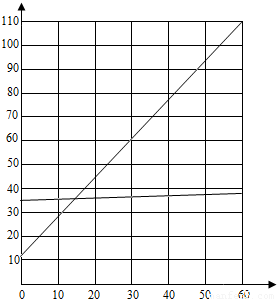
(2)冷却热饱和溶液法;50℃;20℃;硝酸钾晶体;冷水;
(3)增加溶质量、蒸发溶剂和升高温度.
点评:本题难度不是很大,主要考查了根据硝酸钾、氯化钠、氢氧化钙在不同温度时的溶解度情况绘画固体溶解度曲线及混合物的分离方法.进一步巩固学生有关溶液方面的知识.
解答:解:(1)由于固体的溶解度只受一个外界因素---温度的影响,因此氯化钠和硝酸钾的溶解度和温度间的关系如图所示(温度为横坐标,物质的溶解度为纵坐标)
(2)根据三种物质的溶解度曲线可知,由于硝酸钾的溶解度随温度的升高而明显增大,氯化钠的溶解度受温度的影响不大,氢氧化钙的溶解度随温度的升高而减小,故分离氯化钠和硝酸钾应采用的方法是冷却热饱和溶液法;配制氯化钠和硝酸钾混合溶液的最佳温度为50℃;分离时的最佳温度为20℃;在降温过程中,大量析出的物质是硝酸钾晶体,为了提高晶体的纯度,应将过滤出的晶体用冷水清洗.
(3)氢氧化钙的溶解度随温度的升高而减小,要把氢氧化钙的不饱和溶液转变成饱和溶液,可采取的方法有增加溶质量、蒸发溶剂和升高温度.
故答案为:(1)

(2)冷却热饱和溶液法;50℃;20℃;硝酸钾晶体;冷水;
(3)增加溶质量、蒸发溶剂和升高温度.
点评:本题难度不是很大,主要考查了根据硝酸钾、氯化钠、氢氧化钙在不同温度时的溶解度情况绘画固体溶解度曲线及混合物的分离方法.进一步巩固学生有关溶液方面的知识.

练习册系列答案
相关题目
 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.


 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.