题目内容
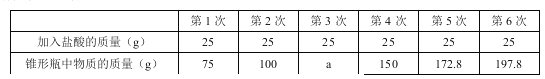
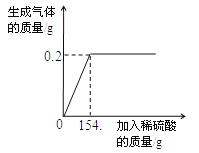
【题目】学习了金属的有关知识后,同学们知道了如何鉴别黄金和黄铜(铜锌合金,俗名“愚人金”),为进一步定量分析黄铜的成分,某同学进行了如下实验:称量黄铜样品20g放入锥形瓶中,向其中不断加入稀硫酸,收集生产的气体与所加稀硫酸的质量关系如图所示。求:
(1)黄铜样品中锌的质量
(2)恰好完全反应时,所得溶液中溶质的质量分数。
【答案】(1)6.5克 (2)10%
【解析】
试题分析:设样品中锌的质量为x,生成硫酸锌的质量为 y。
由图分析可知产生氢气0.2 g。
Zn + H2SO4 ![]() ZnSO4 + H2↑
ZnSO4 + H2↑
65 161 2
x y 0.2 g
65∶2 = x∶0.2 g x=6.5 g
161∶2 = y∶0.2 g y=16.1 g
所得硫酸锌溶液中溶质的质量分数:16.1克/(6.5克+154.7克-0.2克)×100%=10%

练习册系列答案
相关题目