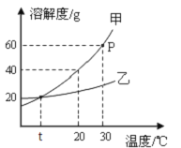
题目内容
【题目】(11分)在实验室中,化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取试剂19.8g放入锥形瓶中,加入30.2g的水,充分振荡,再向锥形瓶中依次滴加25g盐酸充分反应。测得部分数据与图像如下。请根据有关信息回答问题。
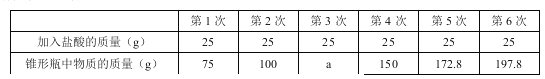
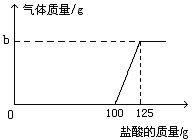
(1)a的数值为 ,兴趣小组的同学通过实验, 得出该试剂己部分变质的结论,其依据是(通过实验数据和图像做出你的分析) 。
(2)b的数值为 。
计算该试剂中氢氧化钙的质量分数(写出计算过程,结果保留一位小数)。
【答案】(1)125;滴加盐酸到100g时,开始有气泡出现,证明有碳酸钙存在;之前加入盐酸无现象,说明盐酸与氢氧化钙反应,从而证明有氢氧化钙存在。
(2)2.2g; 74.7%
【解析】
试题分析:(1)a的数值为125,得出该试剂己部分变质的结论,其依据是滴加盐酸到100g时,开始有气泡出现,证明有碳酸钙存在;之前加入盐酸无现象,说明盐酸与氢氧化钙反应,从而证明有氢氧化钙存在。(2)b=150g+50g-197.8g=2.2g; 解参加反应的碳酸钙的质量为x
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
X 2.2g
100/44=x/2.2g
X=5g
故试剂中氢氧化钙的质量为:19.8g-5g=14.8g
氢氧化钙的质量分数为:14.8g/19.8g×100%=74.7%
答:试剂中氢氧化钙的质量分数为74.7%

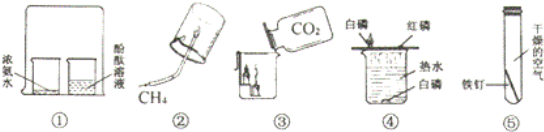
【题目】通过下列实验操作和现象能得出相应结论的是
实验操作 | 现象 | 结论 | |
A | 向收集满CO2的软塑料瓶中加入约 | 塑料瓶变瘪,溶液变红 | CO2能与石蕊反应 |
B | 往久置于空气中的氢氧化钠溶液滴加稀硫酸 | 有气泡 | 氢氧化钠溶液已变质 |
C | 在某无色溶液中滴加氯化钡溶液 | 有白色沉淀 | 无色溶液中一定含有SO42-离子 |
D | 把质量相同的镁条与锌粒同时放入相同浓度和体积的盐酸中 | 镁条与盐酸产生气体更快 | 镁的金属活动性比锌强 |
【题目】下列鉴别物质的试剂或方法,不正确的是
序 号 | 待鉴别的物质 | 鉴别试剂或方法 |
A | 氯化钾与氯化铵固体 | 熟石灰、研磨 |
B | 磷肥与钾肥 | 看外观(颜色) |
C | 氢氧化钠溶液与碳酸钠溶液 | 酚酞溶液 |
D | 聚乙烯与聚氯乙烯塑料 | 点燃闻气味 |